目录
译者概览:
这项研究探讨了黑加仑花青素(BCACs)对开角型青光眼(OAG)患者视力影响,看看它是否能作为抗青光眼药物的补充治疗。
研究为期24个月的研究,共38名对开角型青光眼患者参与,分为两组:
黑加仑花青素组:每日50毫克黑加仑花青素。
安慰剂组:每日服用安慰剂。
主要发现:
视力变化:BCACs的视力恶化较安慰剂组慢,尤其在24个月后,差异显著。
眼部血流:BCACs组眼部血流有明显改善,尤其在视网膜和视神经头部。
其他指标:两组的眼压、血压和脉搏等没有显著差异,且没有副作用。
结论:
口服BCACs可以减缓OAG患者的视力恶化,可能通过改善眼部血流来保护视力。BCACs是一个安全且有前景的抗青光眼补充治疗。
机制推测BCACs可能通过改善眼部血流来减缓青光眼的进展,尤其通过调节血管相关的物质。
简而言之,BCACs对青光眼患者有积极影响,值得作为辅助治疗进一步研究。
引言
青光眼性视神经病变是全球不可逆失明的主要原因之一[1]。眼内压(IOP)升高被广泛认为是青光眼性视神经病变最重要的风险因素,迄今为止,通过抗青光眼药物和/或外科手术降低IOP被认为是最有效的治疗方法[2-5]。然而,降低升高的IOP在某些开角型青光眼(OAG)患者中不足以阻止疾病进展[2-4]。因此,尽管需要在控制IOP之外添加额外的治疗或营养补充剂,但迄今为止还没有支持这一信念的确凿证据。
关于OAG的病因,视网膜和视盘血供被认为是一个重要因素,基于以下证据:(1) OAG患者中可能存在视盘出血[6-8];(2) 视网膜血管疾病,如视网膜静脉阻塞,常与OAG相关[8,9];(3) OAG患者的眼部血流动力学降低[10,11];(4) OAG患者与健康对照组相比,血浆内皮素-1(ET-1)浓度水平异常[12]。此外,我们小组最近发现,与正常受试者相比,OAG患者的血小板聚集能力显著增强[13]。综上所述,视神经头(ONH)的血液循环障碍确实参与了OAG的病因,因此是针对OAG的额外治疗目标。
花青素(ACs)是一种多酚类化合物,富含红酒、可可和浆果等食品和饮料中,已知对健康有多种有益效果[14]。其中,黑莓(BC)中的花青素尤其被认为能改善视觉功能,如暗适应和短暂屈光变化[15]。Matsumoto等人[16]报道,在体外,黑莓花青素(BCACs)刺激牛睫状体的ET依赖性血管扩张。由于ET被认为是调节眼部血流循环的因素之一[17],我们推测BCACs可能改变ET的代谢,并可能对眼部血流动力学(包括ONH)产生有益效果。因此,BCACs可能对眼部血流循环障碍的疾病(如OAG)有效。之前,为了研究BCACs对OAG的影响,向OAG患者每日口服一次含有50 mg BCACs的胶囊(已证明可改善人类志愿者的对比敏感度[15]),持续6个月,并评估了ONH血流和血浆ET-1浓度的变化。口服BCACs胶囊后,ONH下颞侧边缘的血流显著增加(p<0.05),血清ET-1水平变为正常受试者的水平[18]。因此,我们的初步试点研究表明,口服BCACs可能通过改善眼部血流循环,成为OAG患者的一种有前景的补充剂。
在本研究中,目的是调查口服BCACs是否能通过改善ONH的眼部血流循环,防止OAG患者的视场恶化。我们进行了一项为期24个月的随机、安慰剂控制、双盲、队列研究,并比较了两组患者视场恶化的差异。
研究对象与方法
研究对象
OAG患者的临床诊断基于以下诊断标准:(1) 青光眼性视场缺陷与青光眼性视盘变化相对应;(2) 房角镜检查显示正常开放的房角;(3) 无假性剥脱或其他继发性青光眼的历史或发现;(4) 无其他影响视盘损害的眼科、神经科、耳鼻喉科或全身性疾病。从符合条件的250名OAG患者中,共有40名符合以下纳入和排除标准的患者被纳入研究(图1)。
纳入标准
(1) 使用抗青光眼滴眼液治疗超过2年,并在札幌医科大学医院眼科青光眼门诊定期每1-2个月测量IOP,每3-6个月进行Humphrey视场30-2测试(Humphrey Instruments,圣莱安德罗,加利福尼亚,美国)。
(2) 在试验基线时,至少一只眼的Humphrey视场30-2测试平均偏差(MD)优于-12 dB,处于青光眼性视神经病变的早期至中度阶段[19]。
(3) 在试验基线时,至少一只眼的最佳矫正视力为0.6或以上。
(4) Humphrey视场测试30-2程序的可靠性能(注视丢失率低于20%,假阳性或假阴性反应低于33%)以及激光斑点流体成像的瞳孔直径大于3 mm。
排除标准
(1) 除青光眼和早期至轻度老年性白内障外,其他可能影响Humphrey视场测试的眼疾;
(2) 过去2年内有白内障手术史;有青光眼手术史;使用包括ACs在内的补充剂;有药物或食物过敏史。
本研究方案经札幌医科大学医学院伦理委员会批准,并遵循《赫尔辛基宣言》进行。在纳入研究前,向我们青光眼门诊的所有参与者解释了研究目的及其方案,并获得了书面知情同意。
研究设计
这是一项随机、双盲、安慰剂控制的单中心试验。研究招募和随访于2006年11月1日至2010年3月31日在札幌医科大学医院眼科青光眼门诊进行(图1)。符合纳入和排除标准的患者被随机分配至24个月的BCACs组(n=20)或安慰剂组(n=20)。随机化基于由未参与本研究其他方面的生物统计学家(Y.M.)生成的计算机随机列表。该列表在所有患者完成24个月给药后公开。治疗效果在组间进行比较。
关于样本量,我们估计每组需要超过15名患者,以检测组间效果差异,这是基于近期一项关于钙阻滞剂对OAG患者视场影响的随机、安慰剂控制、双盲研究[20]。

方法
ACs(25 mg)从黑莓中提取并装入与placebo相同的胶囊中[18],使患者或医生无法区分。根据分配列表编号,受试者随机接受每日剂量的BCACs(2粒胶囊,50 mg/天,n=20)或placebo胶囊(n=20),持续24个月(图1)。在24个月的前瞻性观察期间,通过回收使用过的胶囊包装确认给药依从性,并在患者每月就诊时进行裂隙灯检查、通过Goldmann压平眼压计测量IOP以及ONH检查。在24个月期间,每6个月测量一次全身血压、通过激光斑点流体成像测量的眼部血流、视力和Humphrey视场30-2测试。所有检查和测量均在上午由不知患者分组的研究人员或技术人员进行。在随访期间,药物基本不更改,且不添加额外的药物或外科干预以降低IOP水平。当研究者认为患者因不良事件无法继续研究、患者撤回参与研究的同意、患者出现影响视场测试的额外眼疾、患者需要额外的全身药物(如抗高血压药和心血管药物)影响眼部血流测量、患者因白内障进展需要外科干预,或患者的观察眼视场损害明显进展并需要更改抗青光眼滴眼液或外科干预时,患者将从研究中移除。
为了评估视场恶化,使用先前描述的[21]高级青光眼干预研究评分,计算与24-2程序对应的测试点。如果评分恶化,将以3个月为间隔重复进行视场测试。当连续两次测试中评分恶化至少4个单位时,定义为阳性视场恶化。
为了评估ONH及其周围视网膜循环,使用先前描述的[22]激光斑点流体成像。简而言之,测量前30分钟,用1滴0.4%托吡卡胺(Mydrin M;Santen,大阪,日本)扩瞳并让患者坐在椅子上休息。激光斑点流体成像(LSFG-NAVI,Softcare Co.,九州,日本;激光波长:830 nm,视角:35°)在包括ONH、上方和下方颞侧盘环以及上方和下方颞侧视网膜周围(排除脉络膜视网膜萎缩和视网膜血管)的5个点连续进行3次。使用平均模糊率(MBR),这是一个在这些观察框架的每个像素点计算的定量指数,指示相对血流速度。在随访期间,选择完全相同的区域并测量相应的MBR,以比较不同时间段。

统计分析
BCAC和安慰剂组基线特征的统计差异使用未配对t检验和Fisher检验确定。在24个月随访期间,通过未配对t检验比较BCAC和安慰剂组在各时间点相对于试验基线的多个观察参数变化差异,包括收缩压、舒张压和平均血压、IOP、视力、ONH、上方和下方颞侧盘边缘以及上方和下方颞侧视网膜周围的MBR,以及视场MD。此外,通过配对t检验比较每组内各时间点上述观察数据的基线值变化。对于IOP和视场MD,还分析了基线前24个月回顾性期间获得的数据,如上所述。
所有统计分析使用SAS版本9.1(SAS Institute Japan,东京,日本)进行。所有统计分析的显著性水平设定为p=0.05。

结果
最初,共40名患者被分配并参与本研究(BCACs,n=20;placebo,n=20)。在24个月观察期间,1名接受BCACs的患者和1名接受安慰剂的患者因观察眼白内障进展接受白内障手术而退出研究(图1)。表1和表2总结了完成24个月研究的患者(BCACs,n=19;placebo,n=19)的基线特征。两组之间在年龄和性别上无显著差异,此外,全身状况(包括收缩压、舒张压和平均血压、脉搏率)和眼部状况(包括视力、IOP、抗青光眼滴眼液数量、Humphrey视场测试30-2程序中的MD,或ONH、其边缘及其周围视网膜的血流)等多个观察内容的差异也不显著。接下来,在24个月研究期间,每6个月比较BCAC和安慰剂组的上述观察内容。
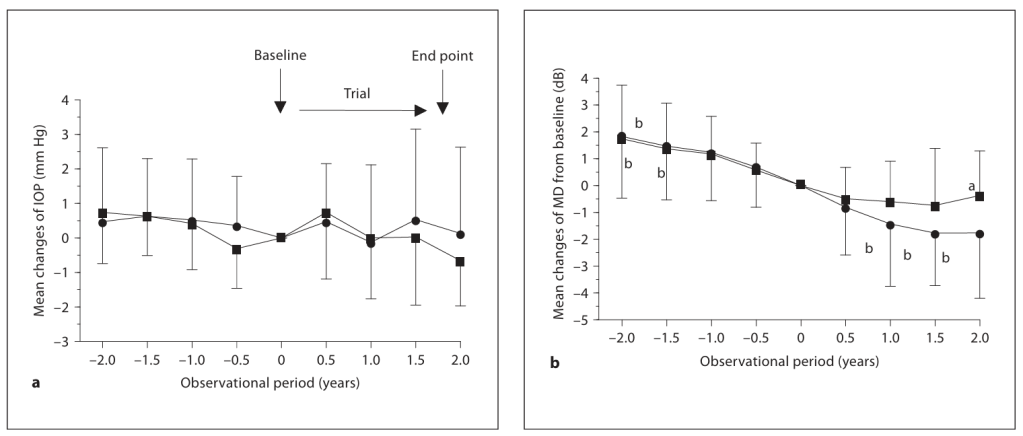
BCAC摄入组(■)和placebo摄入组(○)在回顾性期间(-0.5、-1、-1.5和-2年)和试验期间(0.5、1、1.5和2年)的IOP(a)和MD(b)与基线的差异被绘制。数据表示为均值±标准差。
p<0.05:组间显著差异(未配对t检验);
b p<0.05:各时间点与基线的组内显著差异(配对t检验)。
我们之前的初步试点研究表明,口服BCACs增强了ONH及其周围视网膜的血流[18]。因此,我们推测BCACs可能通过其对眼部血流的功效减缓OAG患者的视场进展。为了验证我们的假设,本研究的主要和次要终点分别选择为从基线到24个月的BCAC和placebo组的视场MD恶化比较以及眼部血流变化。如图2所示,基线后24个月的MD平均恶化在BCAC组显著低于安慰剂组(未配对t检验,p=0.039)。为了探索BCACs对视场MD的影响在观察期间至24个月的哪个时间点出现,在BCAC或placebo组内,检查每6个月从基线开始的组内变化。安慰剂组在12个月后至24个月终点的MD与基线相比显著下降(配对t检验,12个月:p=0.03,18个月:p=0.003,24个月:p=0.007)。相比之下,BCAC组在24个月观察期间的MD无显著变化。为了排除MD恶化和/或IOP控制水平在试验基线时已存在差异的可能性,还检查了基线前24个月回顾性期间的MD和IOP变化,但两组之间未发现显著差异(图2)。作为影响组间MD变化的另一种可能性,推测BCAC组的白内障状况在24个月试验期间可能比placebo组更具进展性。然而,裂隙灯检查显示,两组患者均未显示白内障的明显进展,十进制视力在试验期间未发生变化,两组之间也无统计学差异,如表2所示。
关于眼部血流循环,BCAC组在18个月时下颞侧视网膜周围的平均MBR变化显著高于安慰剂组(未配对t检验,p=0.01;图3)。此外,BCAC组在基线6个月后的ONH、其上方和下方边缘以及下颞侧视网膜周围的MBR平均变化增加。其中,下颞侧视网膜在6个月(配对t检验,p=0.03)和18个月(配对t检验,p=0.01)以及ONH在24个月(配对t检验,p=0.02)的MBR增加具有统计学显著性。然而,placebo组所有测试区域的MBR未显著改变,且在研究期间几乎总是低于BCAC组(图3)。
关于全身状况(包括血压和脉搏率),组间和组内分析未观察到显著变化,除placebo组在24个月时平均舒张压的组内变化显著(p=0.008;图4)。此外,两组均未检测到全身和眼部副作用。



BCAC摄入组(■)和安慰剂摄入组(○)在试验期间(0.5、1、1.5和2年)的ONH(a)、上方颞侧盘边缘(b)、下方颞侧盘边缘(c)、上方颞侧视网膜周围(d)和下方颞侧视网膜周围(e)的MBR与基线的差异被绘制。数据表示为均值±标准差。
p<0.05:组间显著差异(未配对t检验);
b p<0.05:各时间点与基线的组内显著差异(配对t检验)。


BCAC摄入组(■)和安慰剂摄入组(○)在试验期间(0.5、1、1.5和2年)的平均全身收缩压(a)、舒张压(b)、平均血压(c)和脉搏率(d)与基线的差异被绘制。数据表示为均值±标准差。
b p<0.05:各时间点与基线的组内显著差异(配对t检验)。
讨论
几位临床研究者[23-25]揭示,与年龄匹配的对照组相比,OAG患者的视盘边缘血流和视网膜周围血流显著降低,且视盘边缘血流与现有视场缺陷的恶化显著相关。Hafez等人[26]评估并比较了OAG患者和眼高压(OH)患者的视盘边缘血流,发现OAG患者的血流值显著低于OH患者。他们强调,OH患者的视盘边缘血流水平与杯盘比(C/D)的增加呈负相关,即与小C/D比率的视盘相比,大C/D比率的视盘的边缘血流水平显著降低。因此,他们建议,在OH患者出现视场缺陷之前,大C/D比率的患者可能已经存在视盘边缘灌注减少。因此,基于这一证据,强烈建议ONH周围眼部血流障碍确实参与了OAG的发病机制。因此,改善不足的ONH血流循环可能是一种有前景的治疗方法,以防止OAG的恶化。
众所周知,正常视盘的视网膜神经纤维层厚度在ONH的不同部分存在差异(所谓的ISN’T规则),即下部最厚,其次是上部、鼻侧和颞侧[27]。由于视网膜神经纤维层在ONH的下部最厚,该部分的相对血流灌注在ONH中最低,因此该部分被认为是最易受青光眼性视神经损害的区域[28]。研究表明,上方视场比下方视场更容易受累于OAG[29]。如果如建议的那样,ONH下部的血流灌注最低,BCACs对血流循环的有益效果应在ONH的下部最为明显。事实上,在我们之前[18]和当前的研究中,BCACs的全身给药持续增加了ONH下颞侧部分的血流循环。因此,这些观察结果表明,BCACs通过改善ONH及其周围视网膜的眼部血流循环,可能在抗青光眼药物的基础上对OAG的恶化产生预防效果。
已证明黑莓提取物含有多种类黄酮和ACs,它们具有多种健康益处,如抗氧化[30,31]或抗炎特性[32,33]。然而,这些效果的机制尚未完全理解。实际上,已纯化和表征了4种ACs:飞燕草素-3-芸香糖苷、飞燕草素-3-葡萄糖苷、矢车菊素-3-芸香糖苷和矢车菊素-3-葡萄糖苷[34]。口服后,这4种成分直接被吸收并以完整形式存在于血浆中,然后通过血-房水屏障和血-视网膜屏障转移到眼部组织,包括视网膜、脉络膜和睫状体[35]。体外证据表明,转运到眼部组织的此类BCACs引起了多种生物活性,包括刺激青蛙视网膜中视紫红质的再生[36],抑制小鸡近视模型中的眼球延长[37],以及牛睫状体的ET依赖性血管扩张[16]。体内实验表明,口服BCACs显著改善了健康人类志愿者的暗适应和视频显示终端工作诱发的短暂屈光变化[15]。关于ET-1与眼睛的关系,一些研究表明,ET-1受体存在于人类葡萄膜组织[38]、视网膜和ONH[39],提示ET-1可能与缺血性血管疾病(如糖尿病视网膜病变[40]、视网膜静脉阻塞和视网膜动脉阻塞[41]以及青光眼[42-45])相关。先前的研究表明,青光眼患者与对照受试者相比,血浆ET-1水平存在统计学显著差异[12,43,46,47]。在我们最近的研究[18]中,我们发现,口服BCACs胶囊(50 mg/天)使正常眼压青光眼患者的异常血浆ET-1浓度水平正常化,并导致ONH周围眼部血流循环显著增加。基于这些观察,我们推测,口服BCACs可能影响ET-1受体的功能,如其药理反应性和超敏性,从而对眼部血流循环和视场产生有益效果,如上所述。然而,由于黑莓提取物具有多种生物效应,如先前研究所示[30-33],确定BCACs对青光眼性视神经病变有益效果的分子机制是我们下一个项目。
本文翻译自论文Ohguro H, Ohguro I, Katai M, Tanaka S. “Two-year randomized, placebo-controlled study of black currant anthocyanins on visual field in glaucoma.” Ophthalmologica. 2012;228(1):26-35. doi:10.1159/000335961.
参考文献
- Ripodas A, de Juan JA, Roldán-Pallarés M, Bernal R, Moya J, Chao M, López A, Fernández-Cruz A, Fernández-Durango R. Localisation of endothelin-1 mRNA expression and immunoreactivity in the retina and optic nerve from human and porcine eye. Evidence for endothelin-1 expression in astrocytes. Brain Res. 2001;912(2):137-143.
- Shields MB. An overview of glaucoma. In: Shields MB, ed. Textbook of Glaucoma. 4th ed. Baltimore: Williams & Wilkins; 1988:1-2.
- Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol. 1998;126(4):487-497.
- Collaborative Normal-Tension Glaucoma Study Group. The effectiveness of intraocular pressure reduction in the treatment of normal-tension glaucoma. Am J Ophthalmol. 1998;126(4):498-505.
- The AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS): 7. The relationship between control of intraocular pressure and visual field deterioration. Am J Ophthalmol. 2000;130(4):429-440.
- Kass MA, Heuer DK, Higginbotham EJ, Johnson CA, Keltner JL, Miller JP, Parrish RK, Wilson MR, Gordon MO. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-713.
- Kitazawa Y, Shirato S, Yamamoto T. Optic disc hemorrhage in low-tension glaucoma. Ophthalmology. 1986;93(6):853-857.
- Leske MC, Heijl A, Hussein M, Bengtsson B, Hyman L, Komaroff E; Early Manifest Glaucoma Trial Group. Factors for glaucoma progression and the effect of treatment: the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2003;121(1):48-56.
- Barry CJ, Cooper RL, Eikelboom RH. Optic disc hemorrhages and vascular abnormalities in a glaucoma population. Aust N Z J Ophthalmol. 1997;25(2):137-144.
- Hirota A, Mishima HK, Kiuchi Y. Incidence of retinal vein occlusion at the glaucoma clinic of Hiroshima University. Ophthalmologica. 1997;211(5):288-291.
- Jonas JB, Naumann GO. Parapapillary retinal vessel diameter in normal and glaucoma eyes. II. Correlations. Invest Ophthalmol Vis Sci. 1989;30(7):1604-1611.
- Ogawa T, Ogawa A, So K. Target intraocular pressure and risk factors for progression of visual field loss in primary open-angle glaucoma. Nippon Ganka Gakkai Zasshi. 2002;106(8):488-493.
- Ohguro I, Ohguro H, Ohkuro H, Nakazawa M. Study of contribution of low level of plasma endothelin-1 concentration to pathogenesis of glaucomatous optic neuropathy. Hirosaki Med J. 2006;57:59-64.
- Ohguro I, Yamamoto Y, Takeuchi K, Ohguro H, Matsumoto M, Matsuhashi H, Nakazawa M. Relation between platelet aggregation rate and pathogenesis of glaucomatous optic neuropathy. J Eye. 2005;22:669-672.
- Renaud S, de Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet. 1992;339(8808):1523-1526.
- Nakaishi H, Matsumoto H, Tominaga S, Hirayama M. Effects of black currant anthocyanins intake on dark adaptation and VDT work-induced transient refractive alteration in healthy humans. Altern Med Rev. 2000;5(6):553-562.
- Matsumoto H, Kamm KE, Stull JT, Azuma H. Delphinidin-3-rutinoside relaxes the bovine ciliary smooth muscle through activation of ETB receptor and NO/cGMP pathway. Exp Eye Res. 2005;80(3):313-322.
- Haefliger IO, Flammer J, Bény JL, Lüscher TF. Endothelium-dependent vasoactive modulation in the ophthalmic circulation. Prog Retin Eye Res. 2001;20(2):209-225.
- Ohguro I, Ohguro H, Nakazawa M. Effects of anthocyanins in black currant on retinal blood flow circulation of patients with normal tension glaucoma. A pilot study. Hirosaki Med J. 2007;59:23-32.
- Anderson DR, Patella VM. Interpretation of a single field. In: Anderson DR, ed. Automated Static Perimetry. 2nd ed. St Louis: Mosby; 1999:121-190.
- Koseki N, Araie M, Tomidokoro A, Nagahara M, Hasegawa T, Tamaki Y, Yamamoto S. A placebo-controlled 3-year study of a calcium blocker on visual field and ocular circulation in glaucoma with low-normal pressure. Ophthalmology. 2008;115(11):2049-2057.
- Advanced Glaucoma Intervention Study. 2. Visual field test scoring and reliability. Ophthalmology. 1994;101(8):1445-1455.
- Ohguro I, Katai M, Tanaka S, Tsuruta M, Ohguro H. Blood flow in the optic nerve head following instillation of 1% dorzolamide in eyes with glaucoma. Jpn J Clin Ophthalmol. 2010;64:921-926.
- Logan JF, Rankin SJ, Jackson AJ. Retinal blood flow measurements and neuroretinal rim damage in glaucoma. Br J Ophthalmol. 2004;88(8):1049-1054.
- Yaoeda K, Shirakashi M, Fukushima A, Funaki S, Funaki H, Abe H, Tanabe N. Relationship between optic nerve microcirculation and visual field loss in glaucoma. Acta Ophthalmol Scand. 2003;81(3):253-259.
- Sato EA, Ohtake Y, Shinoda K, Mashima Y, Kimura I. Decreased blood flow at neuroretinal rim of optic nerve head corresponds with visual field deficit in eyes with normal tension glaucoma. Graefes Arch Clin Exp Ophthalmol. 2006;244(7):795-801.
- Hafez AS, Bizzarro RLG, Lesk MR. Evaluation of optic nerve head and peripapillary retinal blood flow in glaucoma patients, ocular hypertensive, and normal subjects. Am J Ophthalmol. 2003;136(6):1022-1031.
- Jonas JB, Gusek GC, Naumann GO. Optic disc, cup and neuroretinal rim size, configuration and correlation in normal eyes. Invest Ophthalmol Vis Sci. 1988;29(7):1151-1158.
- Harris A, Ishii Y, Chung HS, Jonescu-Cuypers CP, McCranor LJ, Kagemann L, Garzozi HJ. Blood flow per unit retinal nerve fibre tissue volume is lower in the human inferior retina. Br J Ophthalmol. 2003;87(2):184-188.
- Hart WM, Becker B. The onset and evolution of glaucomatous visual field defect. Ophthalmology. 1982;89(3):268-279.
- McGhie TK, Walton MC. The bioavailability and absorption of anthocyanins: towards a better understanding. Mol Nutr Food Res. 2007;51(6):702-713.
- Møller P, Loft S, Alfthan G, Freese R. Oxidative DNA damage in circulating mononuclear blood cells after ingestion of black currant juice or anthocyanin-rich drink. Mutat Res. 2004;551(1-2):119-126.
- Hirschberg Y, Shackelford A, Mascioli EA, Babayan VK, Bistrian BR, Blackburn GL. The response to endotoxin in guinea pigs after intravenous black currant seed oil. Lipids. 1990;25(8):491-496.
- Karamzawa Y, Kawaguchi K, Takimoto H. Immunomodulating effects of flavanoids on acute and chronic inflammatory responses caused by tumor necrosis factor alpha. Curr Pharm Des. 2006;12(32):4271-4279.
- Matsumoto H, Inaba H, Kishi M, Tominaga S, Hirayama M, Tsuda T. Orally administered delphinidin 3-rutinoside and cyanidin 3-rutinoside are directly absorbed in rats and humans and appear in the blood as the intact forms. J Agric Food Chem. 2001;49(3):1546-1551.
- Matsumoto H, Nakamura Y, Iida H, Ito K, Ohguro H. Comparative assessment of distribution of black currant anthocyanins in rabbit and rat ocular tissues. Exp Eye Res. 2006;83(2):348-356.
- Matsumoto H, Nakamura Y, Tachibanaki S, Kawamura S, Hirayama M. Stimulatory effect of cyanidin 3-glycosides on the regeneration of rhodopsin. J Agric Food Chem. 2003;51(12):3560-3563.
- Iida H, Nakamura Y, Matsumoto H, Takeuchi Y, Harano S, Ishihara M, Katsumi O. Effect of black-currant extract on negative lens-induced ocular growth in chicks. Ophthalmic Res. 2010;44(4):242-250.
- MacCumber MW, D’Anna SA. Endothelin receptor-binding subtypes in the human retina and choroid. Arch Ophthalmol. 1994;112(9):1231-1235.
- Oku H, Kida T, Sugiyama T, Hamada J, Sato B, Ikeda T. Possible involvement of endothelin-1 and nitric oxide in the pathogenesis of proliferative diabetic retinopathy. Retina. 2001;21(6):647-651.
- Stangos AN, Petropoulos IK, Pournaras JA, Mendrinos E, Pournaras CJ. The vasodilatory effect of juxta-arteriolar microinjection of endothelin A receptor inhibitor in healthy and acute branch retinal vein occlusion mini-pig retinas. Invest Ophthalmol Vis Sci. 2010;51(4):2185-2190.
- Kaiser HJ, Flammer J, Wenk M, Lüscher T. Endothelin-1 plasma levels in normal-tension glaucoma: abnormal response to postural changes. Graefes Arch Clin Exp Ophthalmol. 1995;233(8):484-488.
- Nicolela MT, Ferrier SN, Morrison CA, Archibald ML, LeVatte TL, Wallace K, Chauhan BC, LeBlanc RP. Effects of cold-induced vasospasm in glaucoma: the role of endothelin-1. Invest Ophthalmol Vis Sci. 2003;44(6):2565-2572.
- Venkataraman ST, Flanagan JG, Hudson C. Vascular reactivity of optic nerve head and retinal blood vessels in glaucoma. Microcirculation. 2010;17(7):568-581.
- Good TJ, Kahook MY. The role of endothelin in the pathophysiology of glaucoma. Expert Opin Ther Targets. 2010;14(6):647-654.
- Cellini M, Possati GL, Profazio V, Sbrocca M, Caramazza N, Caramazza R. Color Doppler imaging and plasma levels of endothelin-1 in low-tension glaucoma. Acta Ophthalmol Scand Suppl. 1997;224:11-13.
- Kaiser HJ, Flammer J, Wenk M, Lüscher T. Endothelin-1 plasma levels in normal-tension glaucoma: abnormal response to postural changes. Graefes Arch Clin Exp Ophthalmol. 1995;233(8):484-488.