
译者总结黑玛卡与红黄玛卡比较益处
精子发生与精子活力
- 黑玛卡水醇提取物的乙酸乙酯馏分对精子发生的影响最大[42]。
- 煮沸后的提取物(水提取物)具有与玛卡水醇提取物相似的作用[14]。
- 黑玛卡和少量黄玛卡是负责增加精子数量和精子活力的品种,而红玛卡则没有效果[16]。
骨骼结构保护
- 红玛卡和黑玛卡提取物对卵巢切除大鼠的骨骼结构具有保护作用,但对子宫重量没有雌激素作用[28]。
学习和记忆
- 黑色玛卡品种对学习和记忆具有有益的影响。黑玛卡改善了卵巢切除小鼠的学习和记忆[35,37]和东莨菪碱诱导的小鼠记忆障碍[36]。
- 已经研究了三个品种(黑玛卡、红玛卡和黄玛卡),黑玛卡是唯一显示出显著生物学效应的品种[35]。
- 使用玛卡的水醇提取物或煮沸的玛卡水提取物进行的研究,两者在改善记忆和学习方面同样有效[35–37]。
- 黑玛卡(0.5和2.0 g/kg)降低卵巢切除小鼠的脑丙二醛(MDA)水平、氧化应激标志物和乙酰胆碱酯酶(AChE)水平,而单胺氧化酶(MAO)水平没有差异[37]。
- 黑玛卡似乎可以改善卵巢切除术、睾丸切除术、东莨菪碱和酒精引起的实验性记忆障碍,部分原因是其抗氧化和止痛抑制活性。
- 总之,不同的证据表明,玛卡,尤其是黑玛卡,可以改善学习和记忆。
本文译自论文
Gustavo F. Gonzales*
Ethnobiology and Ethnopharmacology of Lepidium meyenii (Maca), a Plant from the Peruvian Highlands
Evid Based Complement Alternat Med. 2012; 2012: 193496.
Published online 2011 Oct 2. doi: 10.1155/2012/193496
以下为论文正文
概述
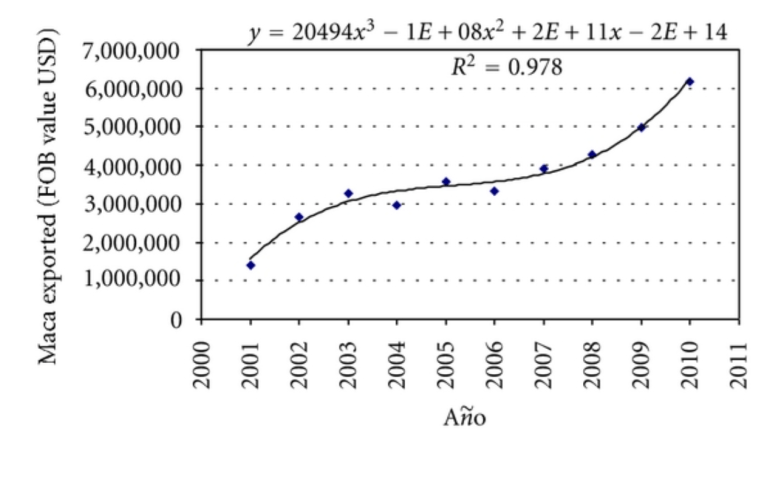
Lepidium meyenii(玛卡)是十字花科的秘鲁植物,栽培了2000多年,仅生长在海拔4000至4500米之间的安第斯山脉中部。玛卡被用作食品补充剂,也因其传统上描述的药用特性而受到关注。自 XX 世纪90年代以来,世界许多地区对玛卡产品的兴趣日益浓厚。在过去十年中,秘鲁的玛卡出口额从2001年的1,415,000美元增加到2010年的6,170,000美元。实验证据表明,玛卡具有营养、活力和生育增强特性,对性功能障碍、骨质疏松、良性前列腺增生、记忆和学习具有作用,并能保护皮肤免受紫外线辐射。临床试验显示玛卡对性功能障碍以及增加精子数量和活力有效。玛卡是一种具有巨大适应原潜力的植物,似乎在预防多种疾病方面具有卓越的营养保健价值。
引言
Lepidium meyenii(玛卡)是一种秘鲁高原植物,海拔4000米以上生长,具有很高的生物勘探潜力[1]。几个世纪以来,玛卡在安第斯山脉一直被用作营养补充并提高人类及动物的生育能力[1,2]。对健康有益食品的需求很高,且在未来几年将持续增长,因此寻找具有此类潜力的植物具有重要意义。
该植物隶属于十字花科芥属[1]。与Lepidium meyenii最相关的种包括油菜、芥菜、萝卜、黑芥菜、卷心菜、花园水芹和水芹。芥属是十字花科中最大的属之一。来自北美和欧洲的种已被广泛研究,而原产安第斯地区的Lepidium meyenii则因其显著的健康益处近年受到大量关注[3–5]。玛卡适应了极寒、高强紫外线和强风的栖息地。玛卡不仅作为食品补充剂使用,还具有假定的药用特性[3]。
安第斯中部秘鲁土著在自然晾干后食用其胚轴,每日摄入量可达20克以上。尚无关于食用玛卡后出现不良反应的报告[4]。然而,当地人建议在食用前对鲜玛卡进行煮沸处理,因为鲜玛卡可能对健康产生不利影响[5]。鲜玛卡的健康影响尚未得到系统科学评估。据报导,玛卡胚轴制剂对健康有益[3–5]。
玛卡在改善生殖功能等健康状况方面具有潜在功效,该假设已获得多项实验证据支持。通过对实验和临床研究中玛卡的历史和生物学特性进行汇总,揭示了其作为营养食品的重要性,以及玛卡在高海拔严苛环境中形成的独特适应性[2,3,5–7]。本综述旨在总结和评估实验及临床研究证据,以验证或否定玛卡在改善各项功能方面的有效性。
历史与传统
玛卡原产于秘鲁安第斯山脉中部的前Chinchaycocha地区(今Junín高原的Carhuamayo和Óndores,靠近Pasco火山区域)[2]。据推测,玛卡约在1300–2000年前在胡宁的圣布拉斯(今Ondores)被首次驯化。
1553年,西班牙征服者编年史家Cieza de León在其著作中首次书面描述了玛卡根,指出秘鲁高原,尤其是Bombón省(Chinchaycocha;今胡宁地区),当地人食用一种无植物学名称的根作维生用途[6]。1653年,科博神父首次记录了“玛卡”名称及其特性,描述该植物生长于Chinchaycocha省最严酷寒冷地带,其他植物难以存活,并提到其增强生育能力[2]。18世纪,鲁伊斯进一步提及玛卡的生育增强和兴奋作用[7],该“兴奋剂”效应可能与能量提升或情绪改善相关。
传统上,玛卡在采收后自然晾干,可长期储存[5]。干燥后的胚轴坚硬如石(图1)。食用前需将干胚轴在水中煮沸至软,以制成果汁形式食用,这是最常见的使用方法[4]。
图1

沸腾过程似乎增加了活性代谢物。事实上,温度升高会影响植物中几种次生代谢物的可用性,有时会增加一些代谢物,而在其他代谢物中观察到代谢物的减少。在玛卡中,重要的成分之一是硫代葡萄糖苷。这些化合物对加热很敏感[8]。然而,其他代谢物在加热后会增加。例如,加热会降低西兰花中硫代蛋白的活性,并增加萝卜硫素(异硫氰酸酯和硫代葡萄糖苷的衍生物)的形成[9]。
在88°C下加热2、15和30分钟后,生番茄的维生素C含量显著下降。然而,每克番茄的番茄红素含量增加[10]。此外,加热西红柿后抗氧化活性也会增加[10]。
民族生物学
玛卡的特点包括地上部分和地下部分。地上部分体积小,外观扁平,这似乎是防止强风影响的适应过程的结果。地下部分是下胚轴——根轴。
植物的主要和可食用部分是萝卜状块茎,构成植物的下胚轴和根。这个下胚轴根轴长10-14厘米,宽3-5厘米,是储存高含水量的储存器官。自然干燥后,下胚轴的尺寸急剧缩小到直径约2-8厘米(图1)。干燥的下胚轴的平均重量可能会有很大差异。例如,根据我们的经验,我们在秘鲁安第斯山脉中部发现了7.64到23.88克的重量范围。
有许多类型的玛卡可以通过其下胚轴的颜色来表征。在秘鲁高地胡宁的Carhuamayo,已经描述了13种颜色的玛卡,从白色到黑色[11]。最近,已证明不同类型的玛卡(根据其颜色)具有不同的生物学特性[16,20,35]。
化学
初级代谢物对应于下胚轴的营养成分,次级代谢物与生物和药用特性相关。
初级代谢物
玛卡干燥的下胚轴含有约13-16%的蛋白质,并富含必需氨基酸。新鲜的下胚轴含有80%的水,并含有大量的铁和钙(见[5])。对干玛卡成分的更完整描述显示[12]10.2%的蛋白质,59%的碳水化合物,2.2%的脂质和8.5%的纤维。玛卡中也存在游离脂肪酸,其中最丰富的是亚油酸、棕榈酸和油酸。饱和脂肪酸占40.1%,而不饱和脂肪酸占52.7%。
玛卡含有氨基酸(mg/g 蛋白质),如亮氨酸(91.0 mg)、精氨酸(99.4 mg)、苯丙氨酸(55.3 mg)、赖氨酸(54.3 mg)、甘氨酸(68.30 mg)、丙氨酸(63.1 mg)、缬氨酸(79.3 mg)、异亮氨酸(47.4 mg)、谷氨酸(156.5 mg)、丝氨酸(50.4 mg)和天冬氨酸(91.7 mg)。其他氨基酸存在但比例较低,包括组氨酸(21.9 mg)、苏氨酸(33.1 mg)、酪氨酸(30.6 mg)、蛋氨酸(28.0 mg)、羟脯氨酸(26 mg)、脯氨酸(0.5 mg)和肌氨酸(0.70 mg)。据报道,在玛卡中发现的矿物质包括铁(16.6 mg/100 g干物质)、钙(150 mg/100 g干物质)、铜(5.9 mg/100 g干物质)、锌(3.8 mg/100 g干物质)和钾(2050 mg/100 g干物质)等(见[5])。
次生代谢物
玛卡含有几种次生代谢产物[5]。次级代谢产物马卡瑞定、马卡尼、马卡酰胺和马卡生物碱仅在该植物中发现[13]。Macaenes是不饱和脂肪酸[13]。其他化合物包括β-谷甾醇、菜油甾醇和豆甾醇。
在玛卡中已经描述了不同的硫代葡萄糖苷,如芳香族硫代葡萄糖苷葡萄糖嗜。硫代葡萄糖苷苄被认为是玛卡生物活性的化学标志物。然而,由于硫代葡萄糖苷可能很容易代谢为异硫氰酸酯和其他较小代谢物中的异硫氰酸酯[14]。
硫代葡萄糖苷苄酯也存在于另一种名为mashua(Tropaeolum tuberosum)的秘鲁植物中。然而,这种植物对玛卡的作用相反,因为对雄性大鼠施用会减少精子数量[15],而玛卡增加精子数量的已知效果[16]。
据观察,不同生产商的玛卡批次中,马卡烯、马卡酰胺、甾醇和硫代葡萄糖苷的含量存在显著差异[17–19]。2005年,第一篇出版物发表,指出不同的玛卡颜色类型具有不同的特性[20]。最近,人们发现玛卡的颜色与不同生物活性代谢物浓度的变化有关[19,21]。这些化合物单独或协同作用可能有利于玛卡所报道的生物学特性。
玛卡颜色之间次级代谢物比例的差异可以解释玛卡所描述的不同生物学特性。
玛卡的民族药理学
实验研究
自2000年至今,已经报道了几项关于玛卡对实验动物的生物学或药理学影响的研究。结果已合并到表1。
表1-实验动物给药后的特性
| 物种 | 特性 | 来源 |
|---|---|---|
| 大鼠 | 增加精子数量和精子活力 | [16] |
| 增加男性性行为 | [13, 22, 23] | |
| 对雄性性行为的影响较小 | [24] | |
| 营养作用 | [25] | |
| 抗压力作用 | [26, 27] | |
| 预防睾酮诱导的前列腺增生 | [20] | |
| 逆转骨质疏松症 | [28, 29] | |
| 神经保护作用 | [30] | |
| 防护紫外线辐射 | [31] | |
| 改善抗氧化状态、脂质和葡萄糖代谢 | [32] | |
| 小鼠 | 增加男性性行为 | [13] |
| 增加胚胎存活率 | [33] | |
| 预防睾酮诱导的前列腺增生 | [34] | |
| 增加后代数量 | [33] | |
| 改善记忆与学习 | [35–37] | |
| 豚鼠 | 增加后代数量 | [38] |
| 鱼类 | 营养作用 | [39, 40] |
| 增加胚胎存活率 | [39] | |
| 公牛 | 改善精子数量和质量 | [41] |
| 交配行为未受影响 |
玛卡的制备过程对于获得足够的生物效应非常重要。传统上,玛卡在食用前会在酒精中煮沸或提取【4】。在实验研究中,玛卡的水提取物只有在水中煮沸粉碎的玛卡下胚轴后才有效。
黑玛卡水醇提取物的乙酸乙酯馏分对精子发生的影响最大【42】。煮沸后的提取物(水提取物)具有与玛卡水醇提取物相似的作用【14】。事实上,玛卡对良性前列腺增生(BPH)的影响似乎与硫代葡萄糖苄的含量有关。红玛卡的水提取物和水醇提取物在相似程度上降低了庚酸睾酮(TE)诱导的前列腺增生大鼠的前列腺重量【14】。
生殖实验研究
男性生殖
性功能
用15、25、75和100mg/kg的玛卡下胚轴粉治疗实验动物,并在治疗1、7、15和21天时评估性行为,得出不同的结果【22,24】。第一项研究发现,男性在治疗第1天和第15天的性行为增加【22】,而第二项研究在治疗第1天或第21天没有发现男性性行为的变化【24】。据报道,玛卡和玛蜜糖是玛卡中的新型化合物【13】,可能负责改善性行为【13】,但这需要进一步证明。
精子功能
已发现玛卡可增加正常大鼠和暴露于高海拔【42】、醋酸铅注射【43】和马拉硫磷【44】产生的病理条件下的精子数量。玛卡还可以增加精子活力【16】。黑玛卡和少量黄玛卡是负责增加精子数量和精子活力的品种,而红玛卡则没有效果【16】。
前列腺功能
对小鼠【34】和大鼠【14,20,45】施用庚酸睾酮(TE)诱导前列腺增生。用TE给雄性大鼠或小鼠21天和42天的红玛卡可预防前列腺增生。黄色玛卡对前列腺大小有中等影响,黑色玛卡对前列腺大小没有影响。事实上,红玛卡以剂量反应的方式降低了前列腺重量,而睾酮水平和精囊重量没有任何变化【14,45】。关于红玛卡对前列腺大小影响的次级代谢物,当评估红玛卡提取物中不同剂量的硫代苄基葡萄糖苷时,观察到前列腺重量的剂量依赖性降低,表明这些化合物可能是红玛卡的生物学效应的原因【14】。然而,红玛卡中呈现的其他次级代谢物也可能是对前列腺大小产生影响的原因。事实上,其他作者发现多酚可以抑制前列腺大小【46,47】。最近,有人提出红玛卡中的多酚可能与前列腺大小的减少有关【34】。
TE给药增加了前列腺锌水平,这是一种诱导前列腺增生的实验模型。红玛卡能够降低TE处理大鼠的锌水平。尽管红玛卡能够逆转TE对前列腺重量和锌水平的影响,但对精囊重量(另一种雄激素依赖性器官)没有影响【20】。非那雄胺是前列腺良性增生的标准药物治疗,可抑制酶5α还原酶的活性,从而阻断睾酮向二氢睾酮的转化,能够降低前列腺和精囊重量,但不能完全降低前列腺中的锌水平(未发表的数据)。我们的研究结果可能表明,红玛卡和非那雄胺可能具有不同的作用机制。事实上,先前的研究表明,红玛卡在不改变TE诱导的前列腺增生小鼠或大鼠的睾酮或雌二醇水平的情况下,对前列腺大小有特异性的影响【14,20,45】。此外,已经发表玛卡对雄激素受体没有影响【48,49】。后者支持红玛卡效应处于雄激素受体后作用水平【14】或RM在二氢睾酮转换后水平发挥抑制作用的假设【45】。
玛卡减少良性前列腺增生(BPH)的发现是科学的贡献,因为没有传统描述提到这种效果。这是可以理解的,因为BPH发生在50岁之间,而在XX世纪之前,预期寿命低于50岁。
血清激素
睾酮控制和精子发生。然而,玛卡对这些生理过程的影响似乎不受血清睾酮或睾丸内睾酮水平变化的调节。然而,其机制尚不清楚【48】。因此,需要进一步的化学和分子研究,以确定玛卡的众多成分中的哪一种可以解释观察到的影响。
雌性生殖
在使用小鼠【50】、大鼠【16,45】或人类【51】的不同研究中,血清雌二醇水平不受影响。此外,通过我们实验室的体外试验,我们无法证明玛卡对MCF-7细胞具有增殖作用【Vaisberg 和 Gonzales,未发表的观察结果】。
玛卡提取物已被证明可以改善小鼠的后代数量【33】。这种效应似乎是由于有利于胚胎存活的效应。虹鳟鱼也有人提出这一点【39,40】。最近,在我们的实验室中,已经证明红玛卡提取物对提高小鼠胚胎质量更有效(未发表的数据)。
红玛卡和黑玛卡提取物对卵巢切除大鼠的骨骼结构具有保护作用,但对子宫重量没有雌激素作用【28】。这一发现可能表明研究玛卡提取物治疗骨质疏松症女性的效果的可能性。
记忆与学习
虽然没有发现关于玛卡对学习和记忆影响的传统描述,但实际上秘鲁中部安第斯山脉的当地人认为在儿童中使用玛卡可以提高学校成绩。他们并不确切知道哪种玛卡对记忆和学习有更好的影响。实验研究表明,在实验动物模型中,黑色玛卡品种对学习和记忆具有有益的影响。黑玛卡改善了卵巢切除小鼠的学习和记忆【35,37】和东莨菪碱诱导的小鼠记忆障碍【36】。
已经研究了三个品种(黑玛卡、红玛卡和黄玛卡),黑玛卡是唯一显示出显著生物学效应的品种【35】。已经使用玛卡的水醇提取物或煮沸的玛卡水提取物进行了研究。两者在改善记忆和学习方面同样有效【35–37】。黑玛卡(0.5和2.0g/kg)降低卵巢切除小鼠的脑丙二醛(MDA)水平、氧化应激标志物和乙酰胆碱酯酶(AChE)水平,而单胺氧化酶(MAO)水平没有差异【37】。黑玛卡似乎可以改善卵巢切除术、睾丸切除术、东莨菪碱和酒精引起的实验性记忆障碍,部分原因是其抗氧化和止痛抑制活性。
总之,不同的证据表明,玛卡,尤其是黑玛卡,可以改善学习和记忆。
在食用玛卡的人群中,肝肾功能、血脂水平和血糖正常。总之,这项研究表明,在传统上使用玛卡的人群中,食用这种食物是安全的【4】。
人类研究
在过去的10年里,全世界对玛卡的兴趣有所增加。对玛卡的兴趣增加也伴随着对安全性的一些担忧。Piacente等(2002)【52】描述了玛卡下胚轴中存在(1R,3S)-1-甲基-1,2,3,4-四氢-β-咔啉-3-羧酸(MTCA)。根据这一发现,作者对MTCA的作用进行了一些概括,表明它可能是有毒的。这些肯定促使法国卫生安全域(AFFSA)发布了关于使用玛卡粉碎根对消费者健康风险的意见【53】。然而,MTCA也发生在柳丁、葡萄柚和果汁等水果上【54】,这些水果因其对健康的有利特性而经常被使用。MTCA已被描述在发酵大蒜提取物上【55,56】。
此外,在几种食物中检测到MTCA,在某些食物中,浓度相对较高(大于皮埃森特在玛卡中发现的浓度),这表明声明被高估了。
在最近的一篇论文中,一些论点表明玛卡中的MTCA是安全的【57】。此外,玛卡不具有致突变性,但它含有几种有益的化合物,其中一些具有抗癌特性【5,58】。玛卡的消费不会引起关注,因为正如法国警报【53】中提到的,在需要煮沸过程的传统玛卡消费情况下,没有报告任何毒性。MTCA是几种植物的天然成分,食用这些植物时没有发现毒性。这表明,作为一种多成分,它可能会失去其作为药物作用的逆境。
此外,最近的一项研究旨在调查秘鲁安第斯山脉中部(Carhuamayo,4100m)传统上食用玛卡的人群的健康情况,并将其与来自同一地方的不食用玛卡的人群进行比较。该研究基于一项调查,评估了35-75岁男性和女性的玛卡消费量、社会人口学方面、健康情况和骨折情况。在子样本中评估肝肾功能和血红蛋白值。从研究的样本来看,80%的人口食用玛卡。其中85%的人食用玛卡是为了营养目的。
玛卡从小就被使用,主要是在下胚轴之后自然干燥。消费主要作为果汁,他们消费的品种是不同颜色的下胚轴的混合物。食用玛卡与健康情况(图2)、骨折率较低、慢性高山病的体征和症状评分较低。此外,食用玛卡与低体重指数和低收缩压有关。
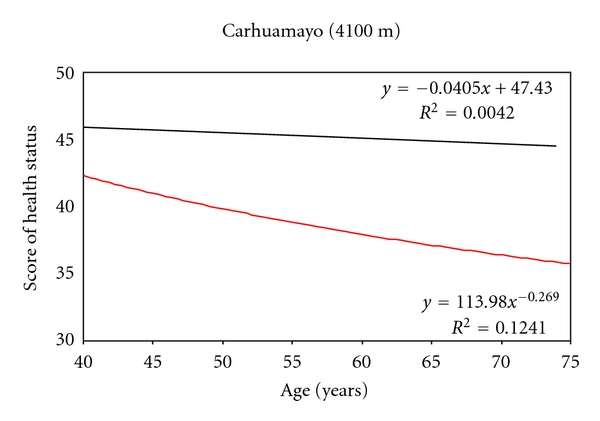
在食用玛卡的人群中,肝肾功能、血脂水平和血糖正常。总之,这项研究表明,在传统上使用玛卡的人群中,食用这种食物是安全的【4】。
玛卡与性功能
性功能障碍在全球范围内非常普遍,男性和女性性功能障碍的发生率直接随着年龄的增长而增加【59】。根据全球18项描述性流行病学研究,20%-30%的男性和40%-45%的女性出现【60】。
大多数性问题与女性和男性的性欲(对性的兴趣)以及男性勃起功能障碍(ED)有关【60】。在过去20年中,人们对药用植物治疗性功能障碍的兴趣有所增加【61】。
玛卡已被描述可以改善实验动物的性行为【13,22,23】。但可能会观察到相互矛盾的结果【24】。传统上,玛卡被称为提高生育能力的植物【2】和能量源【3】。在一项随机研究中,与使用安慰剂的结果相比,我们无法证明玛卡在接受糊化玛卡治疗12周后对看似健康的成年男性勃起的影响【Gonzales,未发表的数据】。
最近,一项关于玛卡对人类性功能影响的系统评价【62】。在本综述中,作者认为只有4项随机临床试验(randomized clinical trial,RCT)符合所有纳入标准【49,63–65】。
根据该综述,两项随机对照试验分别表明玛卡对健康更年期女性【49】或健康成年男性【63】的性功能障碍有显著的积极影响,而另一项随机对照试验则未显示对健康骑自行车者有任何影响。然而,在分析此类研究的结果后,作者发现,与基线试验(P=0.01)相比,玛卡提取物显著改善了自评评分【64】。这项研究的效果早在治疗14天时就已出现,这明显短于糊化玛卡的效果,后者在治疗8周后观察到效果。
另一项随机对照试验(RCT)使用国际勃起功能障碍指数-5(International Index of Erectile Dysfunction-5)评估了玛卡对轻度勃起功能障碍患者的影响,结果显示玛卡对总体和性健康的主观感知有显著影响【65】。
系统评价未纳入一项研究,因为未评估安慰剂效应【66】。在这项研究中,玛卡以两种剂量(1.5克/天和3.0克/天)给药给选择性血清素再摄取抑制剂(SSRI-)诱导的性功能障碍患者。亚利桑那州性体验量表(ASEX)和马萨诸塞州总医院性功能问卷(MGH-SFQ)用于测量性功能障碍。
服用3.0克/天玛卡的受试者的ASEX有显著改善(从22.8 ± 3.8到16.9 ± 6.2;z = −2.20,P = 0.028)和MGH-SFQ评分(从24.1 ± 1.9到17.0 ± 5.7;z = −2.39,P = 0.017),但服用1.5克/天玛卡的受试者没有。根据ASEX项目编号1的显著改善(P < 0.05),但剂量组没有改善。玛卡耐受性良好【66】。
尽管有证据表明玛卡对和轻度勃起功能障碍有影响,但数据显示,玛卡提取物似乎比糊化玛卡【63】和玛卡粉具有更好的效果【64】。这种差异似乎是由于提取物允许次级代谢物的浓度。
总之,有证据表明玛卡可以改善性功能,但对勃起功能的影响尚无定论。
玛卡和精子功能
一项研究纳入了9例看似健康的男性,这些男性在接受玛卡治疗4个月后,精液量、精子数量和精子活力均有所增加【67】(表2)。男性血清激素水平(LH、FSH、催乳素、雌二醇和睾酮)不受玛卡治疗的影响【51,67】。
表2-马卡治疗前和治疗后4个月的精液变数
| 精液变量 | 使用玛卡前 N = 9 | 使用玛卡后 N = 9 | P值 |
|---|---|---|---|
| 体积(mL) | 2.23 ± 0.28 | 2.91 ± 0.28 | <0.05 |
| pH值 | 7.47 ± 0.09 | 7.44 ± 0.07 | NS |
| 精子浓度(10⁶/mL) | 67.06 ± 18.61 | 90.33 ± 20.46 | NS |
| 总精子数量(10⁶/mL) | 140.95 ± 31.05 | 259.29 ± 68.17 | <0.05 |
| 活动精子数量(10⁶/mL) | 87.72 ± 19.87 | 183.16 ± 47.84 | <0.05 |
| 活动精子质量 a (%) | 29.00 ± 5.44 | 33.65 ± 3.05 | NS |
| 活动精子质量 a + b (%) | 62.11 ± 3.64 | 71.02 ± 2.86 | <0.05 |
| 正常精子形态 (%) | 75.50 ± 2.02 | 76.90 ± 1.23 | NS |
玛卡粉和玛卡提取物在前列腺癌细胞系【48】或基于酵母的激素依赖性报告基因试验中无法启动雄激素受体介导的转录【49】。
总之,实验和一项临床研究表明,食用玛卡与精子数量的增加有关。
玛卡作为能量剂
玛卡已被证明可以降低抑郁和焦虑量表的分数【49,66】。一项自我认知调查显示,在看似健康的男性中,玛卡相比安慰剂具有能量作用【3】。
与基线测试相比,玛卡提取物给药14天显著改善了40公里的骑行时间表现(P = 0.01),但与补充后的安慰剂试验相比没有改善(P > 0.05)。
总之,科学证据表明玛卡可能是一种能量剂。
玛卡与代谢综合征
一项研究报告了单独使用玛卡或与另一种补充剂联合使用对代谢综合征患者的影响。这项为期90天的随机安慰剂对照研究评估了玛卡和雪莲果联合水飞薊素对代谢综合征患者血浆和脂蛋白脂质、血清葡萄糖和安全参数的影响。
在使用水飞薊素(0.8 g/天)、水飞薊素+雪莲果(0.8 + 2.4 g/天)和水飞薊素+玛卡(0.6 + 0.2 g/天)的志愿者中未发现不良反应。在使用玛卡(0.6g/d)的志愿者中发现AST水平中度升高和舒张压升高【68】。
然而,一项针对健康男性的随机临床试验显示,糊化玛卡在治疗12周后可降低收缩压和舒张压【3】。此外,玛卡在体外显著抑制高血压相关的血管紧张素I转换酶(ACE)【69】。
在传统上食用玛卡的人群中,收缩压低于不食用玛卡的人群【4】。同样,食用玛卡和不食用玛卡的AST水平相似【4】。
玛卡含有大量的钾【5】。钾是降低高血压风险的重要营养素【70】,作为主要代谢物可能对高血压患者有用。此外,其他次级代谢物也可能具有降低血压的活性【69】。
玛卡和骨关节炎
在一项针对95名骨关节炎患者的随机双盲研究中,将Uncaria guianensis(猫爪;300毫克)和玛卡(1,500毫克)的组合每天给药两次,持续8周,并与氨基葡萄糖硫酸盐治疗进行比较。两种治疗均显著改善了患者的疼痛、僵硬和功能【71】。然而,由于该研究不包括安慰剂对照组,氨基葡萄糖的作用仍不清楚。
毒性
玛卡在秘鲁安第斯山脉中部已经使用了几个世纪,如果煮沸后食用,则没有毒性作用的报告【5】。先前关于玛卡体内和体外研究的综述数据表明,其使用是安全的【5】。进一步的证据表明,玛卡的水提取物和甲醇提取物在体外不具有肝毒性【72】。此外,在小鼠体内冻干玛卡水提取物(1 g/kg BW)未发现对植入前小鼠胚胎正常发育的任何毒性作用【73】。
大鼠的结果表明,不同类型的玛卡(黑色、红色和黄色)在 ≤17 克干燥的下胚轴/公斤体重下没有急性毒性。用1g/kg体重长期治疗84天的大鼠没有副作用,肝脏的组织学表现与对照组相似【74】。由于大鼠的通常剂量为1-2 克/公斤体重,因此建议玛卡是安全的。人类每天摄入 ≤1 克/千克也被认为是安全的。然而,如上文一项针对代谢综合征患者的研究发现,以0.6g/d的剂量给予玛卡,持续90日,导致AST和舒张压中度升高【68】。这在其他研究尚未得到证实【3,4】。秘鲁安第斯山脉中部600名受试者的数据显示,食用玛卡是安全的,健康情况得到改善【4】。
结语
在过去的10年里,全球玛卡的消费量显著增加。这在图3中显示了秘鲁的玛卡出口数据,秘鲁是唯一的玛卡生产国。2010年,秘鲁出口的玛卡价值为6,179,011.8美元,是2001年出口额的4.36倍。
总之,玛卡作为一种营养补充剂和药用植物,具有潜在的健康益处。实验和临床研究提供了支持玛卡在改善生殖功能、增加精子数量、减少性功能障碍、提供能量、保护骨骼结构和降低高血压风险的证据。此外,玛卡在几个世纪以来的传统使用中显示出良好的安全性,并且现代研究也确认了其无毒性。然而,仍需要进一步的研究来确定其各种成分的具体作用机制及其在不同健康状况中的应用效果。
显然,需要进一步的研究来解决这种植物的作用机制和活性原理。然而,现有数据表明,玛卡具有几种重要的生物学特性,这些特性的科学证据对农民、转销商和消费者来说可能很重要。此外,有必要证明玛卡特定次级代谢物的生物学效应及其作为混合物添加时的作用。
玛卡是一种具有巨大适应原潜力的植物,似乎在预防多种疾病方面具有良好的营养保健作用。科学证据表明其对性行为、生育能力、情绪、记忆力、骨质疏松症、新陈代谢和某些肿瘤的治疗有影响。然而,每种效应背后的活性原理仍然未知。獼猴醯胺被描述为玛卡的新型化合物,迄今为止在任何其他植物物种中都没有发现【13】。有人认为,玛卡的这种脂质部分可能是性行为增加的原因【13,23】。睾丸功能、精子发生、生育能力、心境、记忆和前列腺增生【16,35,42,75】的研究均使用仅含有微量醯胺的水提取物【17】。这表明除醯胺以外的化合物负责这些活动。
参考文献:
1. Quiroz C, Aliaga R. Maca (Lepidium meyenii Walp.) In: Hermann M, Hellers J, editors. Andean Roots and Tubers: Ahipa, Arracacha, Maca and Yacon. Promoting the Conservation and Use of Underutilized Neglected Crops. Vol. 21. Rome, Italy: International Plant Genetic Resources Institute; 1997. pp. 173–197. [Google Scholar]
2. Cobo B. History of the New World. Madrid, Spain: Biblioteca de Autores Españoles; 1956. [Google Scholar]
3. Gonzales GF. Biological effects of Lepidium meyenii, maca, a plant from the highlands of Peru. In: Singh VK, Bhardwaj R, Govil JN, Sharma RK, editors. Natural Products. Vol. 15. Houston, Tex, USA: Studium Press; 2006. pp. 209–234. (Recent Progress in Medicinal Plants). [Google Scholar]
4. Gonzales GF. MACA: Del alimento perdido de los Incas al milagro de los Andes: Estudio de seguridad alimentaria y nutricional. Segurança Alimentar e Nutricional, Campinas. 2010;16-17(1):16–36. [Google Scholar]
5. Valerio LG, Gonzales GF. Toxicological aspects of the South American herbs cat’s claw (Uncaria tomentosa) and maca (Lepidium meyenii): a critical synopsis. Toxicological Reviews. 2005;24(1):11–35. [PubMed] [Google Scholar]
6. Cieza de León P. Chronicle of Peru. First Part. London, UK: Hakluyt Society; 1553. [Google Scholar]
7. Ruiz H. Relación histórica del viaje a los reinos del Perú y Chile, 1777-1778. Madrid, Spain: Academia de Ciencias Exactas, Físicas y Naturales; 1952. [Google Scholar]
8. Oerlemans K, Barrett DM, Suades CB, Verkerk R, Dekker M. Thermal degradation of glucosinolates in red cabbage. Food Chemistry. 2006;95(1):19–29. [Google Scholar]
9. Matusheski NV, Juvik JA, Jeffery EH. Heating decreases epithiospecifier protein activity and increases sulforaphane formation in broccoli. Phytochemistry. 2004;65(9):1273–1281. [PubMed] [Google Scholar]
10. Dewanto V, Wu X, Adom KK, Liu RH. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity. Journal of Agricultural and Food Chemistry. 2002;50(10):3010–3014. [PubMed] [Google Scholar]
11. Tello J, Hermann M, Calderón A. La maca (Lepidium meyenii Walp.) cultivo alimenticio potencial para las zonas altoandinas. Bol Lima. 1992;14:59–66. [Google Scholar]
12. Dini A, Migliuolo G, Rastrelli L, Saturnino P, Schettino O. Chemical composition of Lepidium meyenii . Food Chemistry. 1994;49(4):347–349. [Google Scholar]
13. Zheng BL, He K, Kim CH, et al. Effect of a lipidic extract from Lepidium meyenii on sexual behavior in mice and rats. Urology. 2000;55(4):598–602. [PubMed] [Google Scholar]
14. Gonzales GF, Vasquez V, Rodriguez D, et al. Effect of two different extracts of red maca in male rats with testosterone-induced prostatic hyperplasia. Asian Journal of Andrology. 2007;9(2):245–251. [PubMed] [Google Scholar]
15. Cárdenas-Valencia I, Nieto J, Gasco M, et al. Tropaeolum tuberosum (Mashua) reduces testicular function: effect of different treatment times. Andrologia. 2008;40(6):352–357. [PubMed] [Google Scholar]
16. Gonzales C, Rubio J, Gasco M, Nieto J, Yucra S, Gonzales GF. Effect of short-term and long-term treatments with three ecotypes of Lepidium meyenii (MACA) on spermatogenesis in rats. Journal of Ethnopharmacology. 2006;103(3):448–454. [PubMed] [Google Scholar]
17. McCollom MM, Villinski JR, McPhail KL, Craker LE, Gafner S. Analysis of macamides in samples of Maca (Lepidium meyenii) by HPLC-UV-MS/MS. Phytochemical Analysis. 2005;16(6):463–469. [PubMed] [Google Scholar]
18. Ganzera M, Zhao J, Muhammad I, Khan IA. Chemical profiling and standardization of Lepidium meyenii (Maca) by reversed phase high performance liquid chromatography. Chemical and Pharmaceutical Bulletin. 2002;50(7):988–991. [PubMed] [Google Scholar]
19. Clément C, Diaz D, Manrique I, et al. Secondary metabolites in maca as affected by hypocotyl color, cultivation history, and site. Agronomy Journal. 2010;102(2):431–439. [Google Scholar]
20. Gonzales GF, Miranda S, Nieto J, et al. Red maca (Lepidium meyenii) reduced prostate size in rats. Reproductive Biology and Endocrinology. 2005;3, article 5 [PMC free article] [PubMed] [Google Scholar]
21. Clément C, Diaz Grados DA, Avula B, et al. Influence of colour type and previous cultivation on secondary metabolites in hypocotyls and leaves of maca (Lepidium meyenii Walpers) Journal of the Science of Food and Agriculture. 2010;90(5):861–869. [PubMed] [Google Scholar]
22. Cicero AFG, Bandieri E, Arletti R. Lepidium meyenii Walp. improves sexual behaviour in male rats independently from its action on spontaneous locomotor activity. Journal of Ethnopharmacology. 2001;75(2-3):225–229. [PubMed] [Google Scholar]
23. Cicero AFG, Piacente S, Plaza A, Sala E, Arletti R, Pizza C. Hexanic Maca extract improves rat sexual performance more effectively than methanolic and chloroformic Maca extracts. Andrologia. 2002;34(3):177–179. [PubMed] [Google Scholar]
24. Lentz A, Gravitt K, Carson CC, Marson L, Giuliano F. Acute and chronic dosing of Lepidium meyenii (Maca) on male rat sexual behavior. Journal of Sexual Medicine. 2007;4(2):332–340. [PubMed] [Google Scholar]
25. Canales M, Aguilar J, Prada A, Marcelo A, Huamán C, Carbajal L. Nutritional evaluation of Lepidium meyenii (maca) in albino mice and their descendants. Archivos Latinoamericanos de Nutricion. 2000;50(2):126–133. [PubMed] [Google Scholar]
26. López-Fando A, Gómez-Serranillos MP, Iglesias I, Lock O, Upamayta UP, Carretero ME. Lepidium peruvianum chacon restores homeostasis impaired by restraint stress. Phytotherapy Research. 2004;18(6):471–474. [PubMed] [Google Scholar]
27. Tapia A, López C, Marcelo A, Aguilar JL. The Maca (Lepidium meyenii) and their effect antistress in an animal model in mice. Acta Andina. 2000;8:45–56. [Google Scholar]
28. Gonzales C, Cárdenas-Valencia I, Leiva-Revilla J, Anza-Ramirez C, Rubio J, Gonzales GF. Effects of different varieties of Maca (Lepidium meyenii) on bone structure in ovariectomized rats. Forschende Komplementarmedizin. 2010;17(3):137–143. [PubMed] [Google Scholar]
29. Zhang Y, Yu L, Ao M, Jin W. Effect of ethanol extract of Lepidium meyenii Walp. on osteoporosis in ovariectomized rat. Journal of Ethnopharmacology. 2006;105(1-2):274–279. [PubMed] [Google Scholar]
30. Pino-Figueroa A, Nguyen D, Maher TJ. Neuroprotective effects of Lepidium meyenii (Maca) Annals of the New York Academy of Sciences. 2010;1199:77–85. [PubMed] [Google Scholar]
31. Gonzales-Castañeda C, Gonzales GF. Hypocotyls of Lepidium meyenii (maca), a plant of the Peruvian highlands, prevent ultraviolet A-, B-, and C-induced skin damage in rats. Photodermatology Photoimmunology and Photomedicine. 2008;24(1):24–31. [PubMed] [Google Scholar]
32. Večeřa R, Orolin J, Škottová N, et al. The influence of maca (Lepidium meyenii) on antioxidant status, lipid and glucose metabolism in rat. Plant Foods for Human Nutrition. 2007;62(2):59–63. [PubMed] [Google Scholar]
33. Ruiz-Luna AC, Salazar S, Aspajo NJ, Rubio J, Gasco M, Gonzales GF. Lepidium meyenii (Maca) increases litter size in normal adult female mice. Reproductive Biology and Endocrinology. 2005;3, article no. 16 [PMC free article] [PubMed] [Google Scholar]
34. Gonzales GF, Gasco M, Malheiros-Pereira A, Gonzales-Castañeda C. Antagonistic effect of Lepidium meyenii (red maca) on prostatic hyperplasia in adult mice. Andrologia. 2008;40(3):179–185. [PubMed] [Google Scholar]
35. Rubio J, Caldas M, Dávila S, Gasco M, Gonzales GF. Effect of three different cultivars of Lepidium meyenii (Maca) on learning and depression in ovariectomized mice. BMC Complementary and Alternative Medicine. 2006;6, article no. 23 [PMC free article] [PubMed] [Google Scholar]
36. Rubio J, Dang H, Gong M, Liu X, Chen SL, Gonzales GF. Aqueous and hydroalcoholic extracts of Black Maca (Lepidium meyenii) improve scopolamine-induced memory impairment in mice. Food and Chemical Toxicology. 2007;45(10):1882–1890. [PubMed] [Google Scholar]
37. Liu X, Rubio J, Qiong W, et al. Aqueous extract of black maca (Lepidium meyenii) on memory impairment induced by ovariectomy in mice. Evidence-Based Complementary and Alternative Medicine. 2011;2011:7 pages. Article ID 253958. [PMC free article] [PubMed] [Google Scholar]
38. Alvarez CJ. Utilización de diferentes niveles de Maca en la fertilidad de cobayos. Pasco, Peru: Faculty of Agriculture and Cattle Sciences, Universidad Nacional Daniel Alcides Carrión; 1993. Bachellor thesis. [Google Scholar]
39. Lee KJ, Dabrowski K, Rinchard J, Gomez C, Guz L, Vilchez C. Supplementation of maca (Lepidium meyenii) tuber meal in diets improves growth rate and survival of rainbow trout Oncorhynchus mykiss (Walbaum) alevins and juveniles. Aquaculture Research. 2004;35(3):215–223. [Google Scholar]
40. Lee KJ, Dabrowski K, Sandoval M, Miller MJS. Activity-guided fractionation of phytochemicals of maca meal, their antioxidant activities and effects on growth, feed utilization, and survival in rainbow trout (Oncorhynchus mykiss) juveniles. Aquaculture. 2005;244(1–4):293–301. [Google Scholar]
41. Clément C, Kneubühler J, Urwyler A, Witschi U, Kreuzer M. Effect of maca supplementation on bovine sperm quantity and quality followed over two spermatogenic cycles. Theriogenology. 2010;74(2):173–183. [PubMed] [Google Scholar]
42. Gonzales GF, Gasco M, Córdova A, Chung A, Rubio J, Villegas L. Effect of Lepidium meyenii (Maca) on spermatogenesis in male rats acutely exposed to high altitude (4340 m) Journal of Endocrinology. 2004;180(1):87–95. [PubMed] [Google Scholar]
43. Rubio J, Riqueros MI, Gasco M, Yucra S, Miranda S, Gonzales GF. Lepidium meyenii (Maca) reversed the lead acetate induced-Damage on reproductive function in male rats. Food and Chemical Toxicology. 2006;44(7):1114–1122. [PubMed] [Google Scholar]
44. Bustos-Obregón E, Yucra S, Gonzales GF. Lepidium meyenii (Maca) reduces spermatogenic damage induced by a single dose of malathion in mice. Asian Journal of Andrology. 2005;7(1):71–76. [PubMed] [Google Scholar]
45. Gasco M, Villegas L, Yucra S, Rubio J, Gonzales GF. Dose-response effect of Red Maca (Lepidium meyenii) on benign prostatic hyperplasia induced by testosterone enanthate. Phytomedicine. 2007;14(7-8):460–464. [PubMed] [Google Scholar]
46. Chen Q, Ganapathy S, Singh KP, Shankar S, Srivastava RK. Resveratrol induces growth arrest and apoptosis through activation of FOXO transcription factors in prostate cancer cells. PLoS One. 2010;5(12) Article ID e15288. [PMC free article] [PubMed] [Google Scholar]
47. Siddiqui IA, Asim M, Hafeez BB, Adhami VM, Tarapore RS, Mukhtar H. Green tea polyphenol EGCG blunts androgen receptor function in prostate cancer. FASEB Journal. 2011;25(4):1198–1207. [PMC free article] [PubMed] [Google Scholar]
48. Bogani P, Simonini F, Iriti M, et al. Lepidium meyenii (Maca) does not exert direct androgenic activities. Journal of Ethnopharmacology. 2006;104(3):415–417. [PubMed] [Google Scholar]
49. Brooks NA, Wilcox G, Walker KZ, Ashton JF, Cox MB, Stojanovska L. Beneficial effects of Lepidium meyenii (Maca) on psychological symptoms and measures of sexual dysfunction in postmenopausal women are not related to estrogen or androgen content. Menopause. 2008;15(6):1157–1162. [PubMed] [Google Scholar]
50. Oshima M, Gu Y, Tsukada S. Effects of Lepidium meyenii Walp and Jatropha macrantha on blood levels of estradiol-17β, progesterone, testosterone and the rate of embryo implantation in mice. Journal of Veterinary Medical Science. 2003;65(10):1145–1146. [PubMed] [Google Scholar]
51. Gonzalez GF, Córdova A, Vega K, Chung A, Villena A, Góñez C. Effect of Lepidium meyenii (Maca), a root with aphrodisiac and fertility-enhancing propeties, on serum reproductive hormone levels in adult healthy men. Journal of Endocrinology. 2003;176(1):163–168. [PubMed] [Google Scholar]
52. Piacente S, Carbone V, Plaza A, Zampelli A, Pizza C. Investigation of the tuber constituents of maca (Lepidium meyenii Walp.) Journal of Agricultural and Food Chemistry. 2002;50(20):5621–5625. [PubMed] [Google Scholar]
53. APSSA. From the French Agency of Sanitary Security on foods relative to the risk assessment for health by consuming pulverized maca roots or as alimentary supplement. Afssa-Saisine 2004-SA-0155. 1–3, 2004.
54. Herraiz T, Galisteo J. Tetrahydro-β-carboline alkaloids occur in fruits and fruit juices. Activity as antioxidants and radical scavengers. Journal of Agricultural and Food Chemistry. 2003;51(24):7156–7161. [PubMed] [Google Scholar]
55. Sato E, Kohno M, Niwano Y. Increased level of tetrahydro-β-carboline derivatives in short-term fermented garlic. Plant Foods for Human Nutrition. 2006;61(4):175–178. [PubMed] [Google Scholar]
56. Ichikawa M, Yoshida J, Ide N, Sasaoka T, Yamaguchi H, Ono K. Tetrahydro-β-carboline derivatives in aged garlic extract show antioxidant properties. Journal of Nutrition. 2006;136(3) [PubMed] [Google Scholar]
57. Gonzales GF, Gonzales-Castañeda C. The methyltetrahydro-β-carbolines in Maca (Lepidium meyenii) Evidence-Based Complementary and Alternative Medicine. 2009;6(3):315–316. [PMC free article] [PubMed] [Google Scholar]
58. Gonzales GF, Valerio LG. Medicinal plants from Peru: a review of plants as potential agents against cancer. Anti-Cancer Agents in Medicinal Chemistry. 2006;6(5):429–444. [PubMed] [Google Scholar]
59. Derogatis LR, Burnett AL. The epidemiology of sexual dysfunctions. Journal of Sexual Medicine. 2008;5(2):289–300. [PubMed] [Google Scholar]
60. Lewis RW, Fugl-Meyer KS, Corona G, et al. Definitions/epidemiology/risk factors for sexual dysfunction. Journal of Sexual Medicine. 2010;7(4):1598–1607. [PubMed] [Google Scholar]
61. MacKay D. Nutrients and botanicals for erectile dysfunction: examining the evidence. Alternative Medicine Review. 2004;9(1):4–16. [PubMed] [Google Scholar]
62. Shin BC, Lee MS, Yang EJ, Lim HS, Ernst E. Maca (L. meyenii) for improving sexual function: a systematic review. BMC Complementary and Alternative Medicine. 2010;10, article no. 44 [PMC free article] [PubMed] [Google Scholar]
63. Gonzales GF, Córdova A, Vega K, et al. Effect of Lepidium meyenii (MACA) on sexual desire and its absent relationship with serum testosterone levels in adult healthy men. Andrologia. 2002;34(6):367–372. [PubMed] [Google Scholar]
64. Stone M, Ibarra A, Roller M, Zangara A, Stevenson E. A pilot investigation into the effect of maca supplementation on physical activity and sexual desire in sportsmen. Journal of Ethnopharmacology. 2009;126(3):574–576. [PubMed] [Google Scholar]
65. Zenico T, Cicero AFG, Valmorri L, Mercuriali M, Bercovich E. Subjective effects of Lepidium meyenii (Maca) extract on well-being and sexual performances in patients with mild erectile dysfunction: a randomised, double-blind clinical trial. Andrologia. 2009;41(2):95–99. [PubMed] [Google Scholar]
66. Dording CM, Fisher L, Papakostas G, et al. A double-blind, randomized, pilot dose-finding study of maca root (L. meyenii) for the management of SSRI-induced sexual dysfunction. CNS Neuroscience and Therapeutics. 2008;14(3):182–191. [PMC free article] [PubMed] [Google Scholar]
67. Gonzales GF, Córdova A, Gonzales C, Chung A, Vega K, Villena A. Improved sperm count after administration of Lepidium meyenii (maca) in adult men. Asian Journal of Andrology. 2001;3:301–304. [PubMed] [Google Scholar]
68. Valentová K, Stejskal D, Bartek J, et al. Maca (Lepidium meyenii) and yacon (Smallanthus sonchifolius) in combination with silymarin as food supplements: in vivo safety assessment. Food and Chemical Toxicology. 2008;46(3):1006–1013. [PubMed] [Google Scholar]
69. Ranilla LG, Kwon YI, Apostolidis E, Shetty K. Phenolic compounds, antioxidant activity and in vitro inhibitory potential against key enzymes relevant for hyperglycemia and hypertension of commonly used medicinal plants, herbs and spices in Latin America. Bioresource Technology. 2010;101(12):4676–4689. [PubMed] [Google Scholar]
70. Lee J-S, Park J, Kim J. Dietary factors related to hypertension risk in korean adults-data from the Korean national health and nutrition examination survey III. Nutrition Research and Practice. 2011;5(1):60–65. [PMC free article] [PubMed] [Google Scholar]
71. Mehta K, Gala J, Bhasale S, et al. Comparison of glucosamine sulfate and a polyherbal supplement for the relief of osteoarthritis of the knee: a randomized controlled trial [ISRCTN25438351] BMC Complementary and Alternative Medicine. 2007;7, article no. 34 [PMC free article] [PubMed] [Google Scholar]
72. Valentová K, Buckiová D, Křen V, Pěknicová J, Ulrichová J, Šimánek V. The in vitro biological activity of Lepidium meyenii extracts. Cell Biology and Toxicology. 2006;22(2):91–99. [PubMed] [Google Scholar]
73. D’Arrigo G, Benavides V, Pino J. Preliminary evaluation effect of Lepidium meyenii Walp on the embryo development of mouse. Revista Peruana de Biología. 2004;11:103–106. [Google Scholar]
74. Gasco M, Aguilar J, Gonzales GF. Effect of chronic treatment with three varieties of Lepidium meyenii (Maca) on reproductive parameters and DNA quantification in adult male rats. Andrologia. 2007;39(4):151–158. [PubMed] [Google Scholar]
75. Chung F, Rubio J, Gonzales C, Gasco M, Gonzales GF. Dose-response effects of Lepidium meyenii (Maca) aqueous extract on testicular function and weight of different organs in adult rats. Journal of Ethnopharmacology. 2005;98(1-2):143–147. [PubMed] [Google Scholar]