摘要
线粒体是被称为细胞能量工厂的重要细胞器,它们因具有独特的细胞能量生产性质而闻名。随着许多病理条件和衰老的出现,线粒体功能下降,并且腺苷三磷酸(ATP)的生产量减少。这种由细胞呼吸产生的能量携带分子,以及通过戊糖磷酸途径(一种葡萄糖代谢的替代途径)产生。D-核糖是一种自然存在于细胞中的单糖,特别是在线粒体中,对能量生产至关重要。如果能量不足,细胞无法维持完整性和功能。补充D-核糖已被证明能改善存在线粒体功能障碍时的细胞过程。当个体摄入补充的D-核糖时,它可以绕过戊糖途径的一部分,以产生D-核糖-5-磷酸用于能量生产。在本文中,我们回顾了细胞通过细胞呼吸、戊糖途径以及使用补充D-核糖来生产能量的方式。
关键词:腺苷三磷酸、生物能量学、D-核糖、线粒体
引言
线粒体是细胞中最重要的细胞器之一。它们被认为是细胞的动力源,因为有99%的腺苷三磷酸(ATP)是在线粒体内产生的,而ATP是细胞内代谢途径的主要能量来源【1-3】。线粒体功能障碍可能导致极度疲劳和其他常见的症状,这些是患者尤其是心力衰竭患者常有的抱怨。在细胞层面上,线粒体功能的降低通常与电子传输链功能的改变、跨膜电位的化学和电气损失以及线粒体代谢物质的运输减少有关,这些代谢物质对细胞功能是必需的【2,4,5】。
人们认为线粒体是从一种古老的共生关系中发展而来的,其中一个有核细胞被一个好氧原核生物吞噬。在这种内共生关系中,宿主真核细胞逐渐转化为使用氧气产生能量的线粒体【6】。线粒体还包含自己的脱氧核糖核酸(DNA)以及转录和翻译机制。某些疾病现在被认为与线粒体DNA(mtDNA)缺陷有关,这些缺陷有助于底层能量因素的形成【7,8】。D-核糖是戊糖途径中的一种自然存在的单糖,有助于ATP的产生。它是一种5碳链(也称为醛戊糖),是DNA、核糖核酸(RNA)、乙酰辅酶A和ATP的关键组成部分【9】。细胞通过戊糖磷酸途径(PPP)生产D-核糖,该途径对ATP的产生至关重要。在许多疾病或状况下,ATP的合成减少,因此用D-核糖作为补充可能为受损的细胞生物能量学提供一种解决方案【10】。在本文中,我们将回顾细胞通过细胞呼吸、戊糖途径以及使用补充D-核糖来生产能量的方式。
线粒体
线粒体是高度动态的、具有双层膜结构的细胞器(细胞组件),存在于大多数真核细胞的细胞质中,这些细胞含有细胞核【11-14】。线粒体的主要功能是通过其将营养分子中的能量转化并将此能量储存在被称为ATP的分子内的磷酸键中,为细胞生物合成提供化学能量【15-17】。
线粒体内ATP的合成(也称为生物能量学)对于产生正常细胞过程所需的能量至关重要。除了能量产生外,线粒体还在细胞代谢、钙信号传递和细胞死亡等其他机制中发挥作用【18,19】。线粒体还包含一些DNA材料,尽管大部分的基因组数据位于细胞核内【17】。所需的线粒体数量取决于能量需求。例如,需要更多能量的细胞,如骨骼肌细胞,拥有更多的线粒体【20】。
线粒体是椭圆形结构,其大小和分布根据细胞需求而变化【21】。每个线粒体都有一个由蛋白质和磷脂组成的双层膜【22,23】。线粒体的双层膜形成了细胞器内四个不同的组件:(1)光滑轮廓的外膜;(2)两膜间空间;(3)内膜;和(4)基质。外膜在线粒体和细胞其余部分之间创建了一个物理边界【24】。这层膜由单层磷脂双层构成,其中包含称为孔蛋白的蛋白质,这些蛋白质使其能够渗透,从而允许ATP、离子和营养分子等的自由通过【16】。两膜间空间是外膜和内膜之间的区域。基质被包裹在两膜间内,含有一系列参与ATP合成和遗传物质的蛋白质和酶。内膜是一个高度复杂的结构,由许多折叠组成,这些折叠被组织成称为基质的精细层。与外膜不同,内膜不含孔蛋白,对大多数分子高度不可渗透。因此,离子和分子需要专门的运输器进行选择性的膜通过【25,26】。
细胞呼吸
细胞呼吸是一系列发生在线粒体内的生化反应,其结果是ATP的产生【27】。腺苷三磷酸是通过嵌入在内膜中的高度组织化系统生成的。细胞呼吸涉及三个过程:(1)糖解作用;(2)三羧酸循环,也称为克雷布斯循环;以及(3)电子传输链,也称为氧化磷酸化(图1)【28】。
糖解作用是细胞质内的一种无氧途径,在此途径中,一个六碳糖分子葡萄糖被转化为两个由三碳组成的分子称为丙酮酸。通过这条途径,一个葡萄糖分子产生两个ATP分子【29】。糖解作用之后,丙酮酸进入线粒体,并且线粒体基质中的酶系统将丙酮酸转化为称为乙酰辅酶A的二碳分子【28】。
乙酰辅酶A随后进入三羧酸循环,并经历一系列与酶的生化反应,产生二氧化碳和被称为烟酰胺腺嘌呤二核苷酸(NADH)和黄素腺嘌呤二核苷酸(FADH2)的电子载体分子。每个经历糖解作用的葡萄糖分子产生两个额外的ATP分子。大部分的ATP是在细胞呼吸的最后阶段产生的,这是一条称为电子传输链的有氧途径【30】。
电子传输链由一组复杂的蛋白质组成,称为蛋白质复合体I至IV,它们位于线粒体内膜内【31】。NADH和FADH2分子中的氢电子通过从一个复合体到另一个复合体的运输链传递,创造出跨膜的质子梯度。电子的能量转移被用来通过整个基质表面把质子泵过膜空间。一旦膜空间中的电子浓度梯度变高,质子通过称为ATP合成酶的酶向较低浓度的线粒体基质区域迁移【32】。此酶通过二磷酸腺苷(ADP)的磷酸化催化ATP的产生。电子传递链途径产生约34个额外的ATP分子。因此,细胞呼吸从一个葡萄糖分子产生约38个ATP分子(图1)【33】。
D-核糖
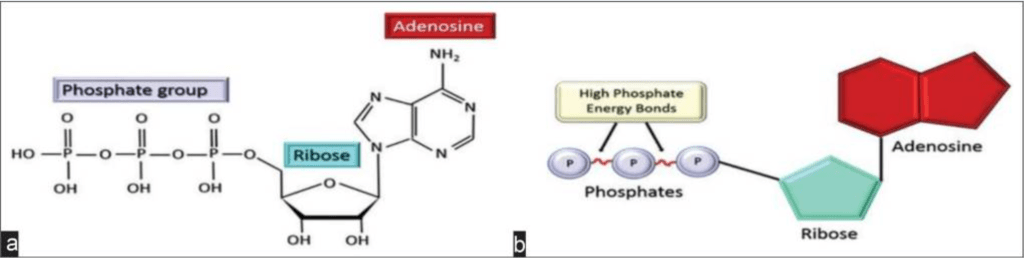
D-核糖是ATP分子的一种能量产生基质,常被称为“分子货币”,因为它在细胞内能量传递中的作用。腺苷三磷酸由磷酸、核糖和腺苷基团组成,这些基团通过分子内的两个高能磷酸酐键连接。(图2)【34】

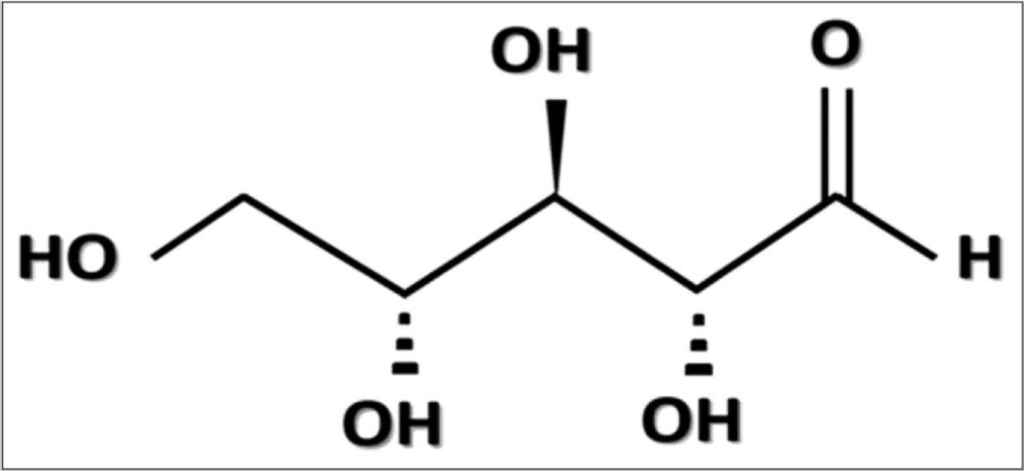
作为一种戊糖,D-核糖在其环状结构中有五个碳;化学结构(图3),分子量为150.13 g/mol【35】。
ATP分子能够在细胞内储存和运输化学能量,对于合成如DNA和RNA的核酸至关重要。核糖是一种自然生成的五碳糖,在体内通过PPP(戊糖磷酸途径)产生,这是一个与糖解作用平行的代谢途径,能够生成烟酰胺腺嘌呤二核苷磷酸(NADPH)、戊糖和核糖5-磷酸。PPP是一个缓慢的过程,需要一种称为葡萄糖6-磷酸脱氢酶(G-6-PDH)的酶,而这种酶在细胞内往往供应不足(图4)。在心脏疾病的心肌细胞中,这种酶的表达可能有限,导致核糖的产生显著延迟【36】。

有两条主要途径——从头合成途径和拯救途径——用于合成核苷酸。利用5-磷酸核糖基-1-焦磷酸(PRPP),从头合成途径的酶从过程的开始就使用核糖构建嘌呤和嘧啶核苷酸。这条途径比利用预先形成的核糖让细胞能够快速高效地回收ATP终产物的拯救途径慢得多。线粒体使用ATP代谢产物形成新的ATP进行能量产生。因此,核糖对从头合成途径和拯救途径都至关重要【37-39】。
补充D-核糖
在某些病理条件下,例如心力衰竭,心肌线粒体存在细胞能量缺乏。ATP产量的减少与线粒体中D-核糖供应的减少直接相关。这可能与心肌中G-6-PDH酶的有限表达有关,这可能显著中断核糖的产生。一些研究表明,在心肌缺血后增加D-核糖可以通过增加心肌ATP产量来改善线粒体功能【40】。
补充D-核糖可绕过酶促步骤以协助补充细胞中的ATP水平。在嘌呤代谢中,D-葡萄糖被转化为D-核糖-6-磷酸和D-核糖-5-磷酸,然后被转化为5-磷酸-D-核糖1焦磷酸(PRPP)以合成嘌呤和嘧啶(图5)。换句话说,补充D-核糖绕过了速率控制的PPP(较慢途径),并为ATP产生提供了另一个PRPP的来源。

D-核糖在许多不同的病理条件下被用于口服和静脉注射给患者,如慢性疲劳综合症【41】、纤维肌痛【42】和心肌功能障碍【40】。它经常被用来改善运动表现,并减少运动后的痉挛、疼痛和僵硬症状【41】。在不同的病理条件下,ATP、ADP和腺苷单磷酸被降解,不能用于能量产生。补充D-核糖已被证明能增强ATP水平的恢复并减少人类和动物的细胞损伤【9,43】。Pliml等人的研究发现,严重冠状动脉疾病的患者连续三天服用D-核糖后,心肌对缺血的耐受性有所改善。他们假设补充D-核糖增加了ATP代谢,并协助恢复心脏能量代谢【44】。另一组研究人员发现,每天口服D-核糖显著改善了充血性心力衰竭患者的左心房功能。他们证明补充D-核糖不仅改善了舒张功能,还提高了患者的身体活动功能和生活质量。
补充D-核糖可以以干粉形式购买,推荐剂量范围从每天5至15克,不按体重单位计算【42】。粉末混合在非碳酸饮料中,味道甜。如果在混合液体后30分钟内消耗,则能迅速代谢。副作用很小,但患者报告了轻微的腹泻、轻微的恶心和胃部不适,这些症状可以通过与食物一起消耗饮料来减少【45-47】。之前有些关于核糖治疗安全性的担忧,与核糖对体外细胞增殖的抑制作用有关。然而,Pliml等人调查了核糖对人类淋巴细胞可能的副作用。他们发现,在体外刺激的细胞中,人类淋巴细胞的增殖没有显著抑制,也没有证据表明核糖治疗对人类细胞有害【48】。
结论
线粒体调节着众多代谢和信号传递途径,但它们的主要功能是产生ATP。当线粒体功能受损时,细胞呼吸的效率可能降低,从而导致ATP产生的损失。D-核糖是细胞内自然存在的ATP底物。当核苷酸减少时,补充D-核糖已被证明对于增强这些能量分子的恢复非常有用。因此,D-核糖补充可能有助于将腺苷核苷酸返回到细胞,从而成为各种病理生理条件的潜在治疗选择。
本文翻译自论文 Diane E. Mahoney, et al. “Understanding D-Ribose and Mitochondrial Function” Adv Biosci Clin Med. Author manuscript; available in PMC 2018 May 18.
参考文献:
1. Martin-Fernandez B, Gredilla R. Mitochondria and oxidative stress in heart aging. Age (Dordr) 2016;38:225–238. doi: 10.1007/s11357-016-9933-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2. Wallace DC, Fan W, Procaccio V. Mitochondrial energetics and therapeutics. Annu Rev Pathol. 2010;5:297–348. doi: 10.1146/annurev.pathol.4.110807.092314. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
3. Schapira AH. Mitochondrial disease. Lancet. 2006;368:70–82. doi: 10.1016/S0140-6736(06)68970-8. [PubMed] [CrossRef] [Google Scholar]
4. Nicolson GL. Mitochondrial Dysfunction and Chronic Disease: Treatment With Natural Supplements. Integr Med (Encinitas) 2014;13:35–43. [PMC free article] [PubMed] [Google Scholar]
5. Lesnefsky EJ, Chen Q, Hoppel CL. Mitochondrial Metabolism in Aging Heart. Circ Res. 2016;118:1593–1611. doi: 10.1161/CIRCRESAHA.116.307505. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
6. Lane N. Energetics and genetics across the prokaryote-eukaryote divide. Biol Direct. 2011;6:35. doi: 10.1186/1745-6150-6-35. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Picard M, Wallace DC, Burelle Y. The rise of mitochondria in medicine. Mitochondrion. 2016;30:105–116. doi: 10.1016/j.mito.2016.07.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Chinnery PF, Hudson G. Mitochondrial genetics. Br Med Bull. 2013;106:135–159. doi: 10.1093/bmb/ldt017. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
9. Pauly DF, Pepine CJ. D-Ribose as a supplement for cardiac energy metabolism. J Cardiovasc Pharmacol Ther. 2000;5:249–258. doi: 10.1054/JCPT.2000.18011. [PubMed] [CrossRef] [Google Scholar]
10. Herrick J, St Cyr J. Ribose in the heart. J Diet Suppl. 2008;5:213–217. doi: 10.1080/19390210802332752. [PubMed] [CrossRef] [Google Scholar]
11. Leites EP, Morais VA. Mitochondrial quality control pathways: PINK1 acts as a gatekeeper. Biochem Biophys Res Commun. 2017 doi: 10.1016/j.bbrc.2017.06.096. [PubMed] [CrossRef] [Google Scholar]
12. Ettema TJ. Evolution: Mitochondria in the second act. Nature. 2016;531:39–40. doi: 10.1038/nature16876. [PubMed] [CrossRef] [Google Scholar]
13. Agrawal A, Mabalirajan U. Rejuvenating cellular respiration for optimizing respiratory function: targeting mitochondria. Am J Physiol Lung Cell Mol Physiol. 2016;310:L103–113. doi: 10.1152/ajplung.00320.2015. [PubMed] [CrossRef] [Google Scholar]
14. Wei H, Liu L, Chen Q. Selective removal of mitochondria via mitophagy: distinct pathways for different mitochondrial stresses. Biochim Biophys Acta. 2015;1853:2784–2790. doi: 10.1016/j.bbamcr.2015.03.013. [PubMed] [CrossRef] [Google Scholar]
15. Mills EL, Kelly B, O’Neill LAJ. Mitochondria are the powerhouses of immunity. Nat Immunol. 2017;18:488–498. doi: 10.1038/ni.3704. [PubMed] [CrossRef] [Google Scholar]
16. Kim SJ, Xiao J, Wan J, Cohen P, Yen K. Mitochondrially derived peptides as novel regulators of metabolism. J Physiol. 2017;595:6613–6621. doi: 10.1113/JP274472. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
17. de Almeida A, Ribeiro TP, de Medeiros IA. Aging: Molecular Pathways and Implications on the Cardiovascular System. Oxid Med Cell Longev. 2017;2017:7941563. doi: 10.1155/2017/7941563. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Feng D, Liu L, Zhu Y, Chen Q. Molecular signaling toward mitophagy and its physiological significance. Exp Cell Res. 2013;319:1697–1705. doi: 10.1016/j.yexcr.2013.03.034. [PubMed] [CrossRef] [Google Scholar]
19. Polster BM, Carri MT, Beart PM. Mitochondria in the nervous system: From health to disease, Part I. Neurochem Int. 2017;109:1–4. doi: 10.1016/j.neuint.2017.09.006. [PubMed] [CrossRef] [Google Scholar]
20. Liesa M, Shirihai OS. Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell Metab. 2013;17:491–506. doi: 10.1016/j.cmet.2013.03.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Gomes LC, Scorrano L. Mitochondrial morphology in mitophagy and macroautophagy. Biochim Biophys Acta. 2013;1833:205–212. doi: 10.1016/j.bbamcr.2012.02.012. [PubMed] [CrossRef] [Google Scholar]
22. Tamura Y, Sesaki H, Endo T. Phospholipid transport via mitochondria. Traffic. 2014;15:933–945. doi: 10.1111/tra.12188. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
23. Zhang Q, Tamura Y, Roy M, Adachi Y, Iijima M, Sesaki H. Biosynthesis and roles of phospholipids in mitochondrial fusion, division and mitophagy. Cell Mol Life Sci. 2014;71:3767–3778. doi: 10.1007/s00018-014-1648-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24. Meyer JN, Leuthner TC, Luz AL. Mitochondrial fusion, fission, and mitochondrial toxicity. Toxicology. 2017;391:42–53. doi: 10.1016/j.tox.2017.07.019. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Wasilewski M, Chojnacka K, Chacinska A. Protein trafficking at the crossroads to mitochondria. Biochim Biophys Acta. 2017;1864:125–137. doi: 10.1016/j.bbamcr.2016.10.019. [PubMed] [CrossRef] [Google Scholar]
26. Neupert W. A perspective on transport of proteins into mitochondria: a myriad of open questions. J Mol Biol. 2015;427:1135–1158. doi: 10.1016/j.jmb.2015.02.001. [PubMed] [CrossRef] [Google Scholar]
27. Martinez-Reyes I, Diebold LP, Kong H, Schieber M, Huang H, Hensley CT, Mehta MM, Wang T, et al. TCA Cycle and Mitochondrial Membrane Potential Are Necessary for Diverse Biological Functions. Mol Cell. 2016;61:199–209. doi: 10.1016/j.molcel.2015.12.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
28. Donnelly RP, Finlay DK. Glucose, glycolysis and lymphocyte responses. Mol Immunol. 2015;68:513–519. doi: 10.1016/j.molimm.2015.07.034. [PubMed] [CrossRef] [Google Scholar]
29. Lunt SY, Muralidhar V, Hosios AM, Israelsen WJ, Gui DY, Newhouse L, Ogrodzinski M, Hecht V, et al. Pyruvate kinase isoform expression alters nucleotide synthesis to impact cell proliferation. Mol Cell. 2015;57:95–107. doi: 10.1016/j.molcel.2014.10.027. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Sutendra G, Kinnaird A, Dromparis P, Paulin R, Stenson TH, Haromy A, Hashimoto K, Zhang N, et al. A nuclear pyruvate dehydrogenase complex is important for the generation of acetyl-CoA and histone acetylation. Cell. 2014;158:84–97. doi: 10.1016/j.cell.2014.04.046. [PubMed] [CrossRef] [Google Scholar]
31. Rieger B, Junge W, Busch KB. Lateral pH gradient between OXPHOS complex IV and F(0)F(1) ATP-synthase in folded mitochondrial membranes. Nat Commun. 2014;5:3103. doi: 10.1038/ncomms4103. [PubMed] [CrossRef] [Google Scholar]
32. Kuhlbrandt W. Structure and function of mitochondrial membrane protein complexes. BMC Biol. 2015;13:89. doi: 10.1186/s12915-015-0201-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
33. Matta CF, Massa L. Energy Equivalence of Information in the Mitochondrion and the Thermodynamic Efficiency of ATP Synthase. Biochemistry. 2015;54:5376–5378. doi: 10.1021/acs.biochem.5b00834. [PubMed] [CrossRef] [Google Scholar]
34. Ghosh K, Debasis K, Purnendu R. Benzimidazolium-based simple host for fluorometric sensing of H2PO4, F–, PO43- and AMP under different conditions. Tetrahedron Letters. 2011;52:5098–5103. doi: 10.1016/j.tetlet.2011.07.110. [CrossRef] [Google Scholar]
35. Vyas NK, Vyas MN, Quiocho FA. Comparison of the periplasmic receptors for L-arabinose, D-glucose/D-galactose, and D-ribose. Structural and Functional Similarity. J Biol Chem. 1991;266:5226–5237. [PubMed] [Google Scholar]
36. Wamelink MM, Struys EA, Jakobs C. The biochemistry, metabolism and inherited defects of the pentosephosphate pathway: a review. J Inherit Metab Dis. 2008;31:703–717. doi: 10.1007/s10545-008-1015-6. [PubMed] [CrossRef] [Google Scholar]
37. Tanuma S, Sato A, Oyama T, Yoshimori A, Abe H, Uchiumi F. New Insights into the Roles of NAD+ -Poly(ADP-ribose) Metabolism and Poly(ADP-ribose) Glycohydrolase. Curr Protein Pept Sci. 2016;17:668–682. [PubMed] [Google Scholar]
38. Link H, Fuhrer T, Gerosa L, Zamboni N, Sauer U. Real-time metabolome profiling of the metabolic switch between starvation and growth. Nat Methods. 2015;12:1091–1097. doi: 10.1038/nmeth.3584. [PubMed] [CrossRef] [Google Scholar]
39. Frenguelli BG. The Purine Salvage Pathway and the Restoration of Cerebral ATP: Implications for Brain Slice Physiology and Brain Injury. Neurochem Res. 2017 doi: 10.1007/s11064-017-2386-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
40. Bayram M, St Cyr JA, Abraham WT. D-ribose aids heart failure patients with preserved ejection fraction and diastolic dysfunction: a pilot study. Ther Adv Cardiovasc Dis. 2015;9:56–65. doi: 10.1177/1753944715572752. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
41. Jones K, Probst Y. Role of dietary modification in alleviating chronic fatigue syndrome symptoms: a systematic review. Aust N Z J Public Health. 2017;41:338–344. doi: 10.1111/1753-6405.12670. [PubMed] [CrossRef] [Google Scholar]
42. Thompson J, Neutel J, Homer K, Tempero K, Shah A, Khankari R. Evaluation of D-ribose pharmacokinetics, dose proportionality, food effect, and pharmacodynamics after oral solution administration in healthy male and female subjects. J Clin Pharmacol. 2014;54:546–554. doi: 10.1002/jcph.241. [PubMed] [CrossRef] [Google Scholar]
43. St Cyr JA, Bianco RW, Schneider JR, Mahoney JR, Jr, Tveter K, Einzig S, Foker JE. Enhanced high energy phosphate recovery with ribose infusion after global myocardial ischemia in a canine model. J Surg Res. 1989;46:157–162. [PubMed] [Google Scholar]
44. Pliml W, von Arnim T, Stablein A, Hofmann H, Zimmer HG, Erdmann E. Effects of ribose on exercise-induced ischaemia in stable coronary artery disease. Lancet. 1992;340:507–510. [PubMed] [Google Scholar]
45. Wagner DR, Gresser U, Kamilli I, Gross M, Zollner N. Effects of oral ribose on muscle metabolism during bicycle ergometer in patients with AMP-deaminase-deficiency. Adv Exp Med Biol. 1991;309B:383–385. [PubMed] [Google Scholar]
46. Teitelbaum JE, Johnson C, St Cyr J. The use of D-ribosein chronic fatigue syndrome and fibromyalgia: a pilot study. J Altern Complement Med. 2006;12:857–862. doi: 10.1089/acm.2006.12.857. [PubMed] [CrossRef] [Google Scholar]
47. Seifert J, Frelich A, Shecterle L, St Cyr J. Assessment of Hematological and Biochemical parameters with extended D-Ribose ingestion. J Int Soc Sports Nutr. 2008;5:13. doi: 10.1186/1550-2783-5-13. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Pliml W, von Arnim T, Hammer C. Effects of therapeutic ribose levels on human lymphocyte proliferation in vitro. Clin Investig. 1993;71:770–773. [PubMed] [Google Scholar]