译者小结:
研究表明,摄入的叶黄素可在脊椎动物眼中由 RPE65 酶转化为内消旋玉米黄素(meso‑zeaxanthin),这一过程已在鸡胚胎和人体细胞中得到验证。内消旋玉米黄素是黄斑色素的重要组成,在视窝中心富集,与叶黄素和玉米黄素共同保护视网膜,降低年龄相关性黄斑变性(AMD)风险。
重要性
类胡萝卜素是植物来源的色素分子,高等生物无法自主合成。这些化合物既是强效抗氧化剂,又能屏蔽有害光线,其补充已被证实可改善年龄相关性黄斑变性等疾病的进展。植物界存在数百种类胡萝卜素,但灵长类黄斑仅含三种:叶黄素、玉米黄素和内消旋玉米黄素。内消旋玉米黄素在灵长类视窝区的存在一直未能通过饮食获得来解释。本研究揭示,RPE65 催化叶黄素向内消旋玉米黄素的转化,是其在类胡萝卜素代谢中除了视黄醇异构水解酶功能之外的独特作用。
摘要
类胡萝卜素是植物来源的色素分子,脊椎动物无法从头合成,能保护灵长类视网膜视窝免受氧化应激和光损伤。内消旋玉米黄素是一种眼部特有的类胡萝卜素,饮食中不常见,却是视窝中心三大类胡萝卜素之一,其生成机制尚不明确。此前假设有一种异构酶可通过双键迁移将叶黄素转化为内消旋玉米黄素,但其身份未明。我们早先发现,内消旋玉米黄素在鸡胚胎 RPE(视网膜色素上皮)/脉络膜中随发育调节生成,与光照无关。本研究表明,RPE65——脊椎动物视觉循环中的异构水解酶——不仅催化全反式视黄酯异构为 11‑顺式视黄醇,也负责脊椎动物内消旋玉米黄素的生物合成。鸡胚胎发育期间,RPE65 的 RNA 水平在内消旋玉米黄素生成期上调约 23 倍;体外细胞实验中,过表达鸡源或人源 RPE65 可由叶黄素生成内消旋玉米黄素;药理抑制 RPE65 活性则显著抑制鸡胚视网膜内消旋玉米黄素合成。结构对接分析显示,叶黄素的 ε 环可嵌入 RPE65 的活性位点,邻近非血红素铁中心。本报告首次揭示了 RPE65 在眼部类胡萝卜素代谢中的额外生化活性。
正文
罕见的类胡萝卜素内消旋玉米黄素仅存在于高等脊椎动物的眼中(1,2),这一自然现象尤为独特,因为脊椎动物通常通过饮食获取类胡萝卜素,且自身无法合成(2,3)。饮食中很少含有内消旋玉米黄素;除脊椎动物眼部外,该类胡萝卜素仅见于虾壳、龟脂和鱼皮中(2,4,5)。尽管灵长类摄入超过 50 种类胡萝卜素,视网膜视窝中心仅富集叶黄素、玉米黄素和内消旋玉米黄素,这一区域负责清晰的中央视力。视网膜及其周围的视网膜色素上皮(RPE)受损会导致年龄相关性黄斑变性(AMD)。类胡萝卜素补充已被证明能减缓该病的进展,因为它们能保护视窝免受蓝光损伤和活性氧(ROS)的侵害(2,6)。尽管内消旋玉米黄素在视窝中心的含量最高,其相对于饮食来源的叶黄素和玉米黄素的特殊功能尚待阐明。
叶黄素、玉米黄素和内消旋玉米黄素是视窝中心的三大类胡萝卜素(2),均具有相同的分子式 C₄₀H₅₆O₂(图1A)。由于叶黄素和玉米黄素在日常饮食中丰富,长期以来假设某种异构酶通过双键迁移将其转化为内消旋玉米黄素(2)。我们实验室在鹌鹑体内研究中发现,喂食氘标记叶黄素的鸟类其视网膜会生成标记的内消旋玉米黄素,而喂食标记玉米黄素则无此现象(7)。灵长类动物亦有类似观察:在类胡萝卜素缺乏的猴子中,补充叶黄素可在视网膜中检测到内消旋玉米黄素,而补充玉米黄素则不行(8)。这两项研究均表明,叶黄素在体内可代谢生成内消旋玉米黄素,但其生化机制不明;在工业条件下(如高温强碱)此反应可高效发生(9)。从饮食玉米黄素生成内消旋玉米黄素需翻转 3′ 位手性中心,生物体系中极为罕见;而叶黄素转化仅需将双键从 4′‑5′ 移动至 5′‑6′,可通过酸碱催化轻松实现(图1B),自由基机制亦可能参与。
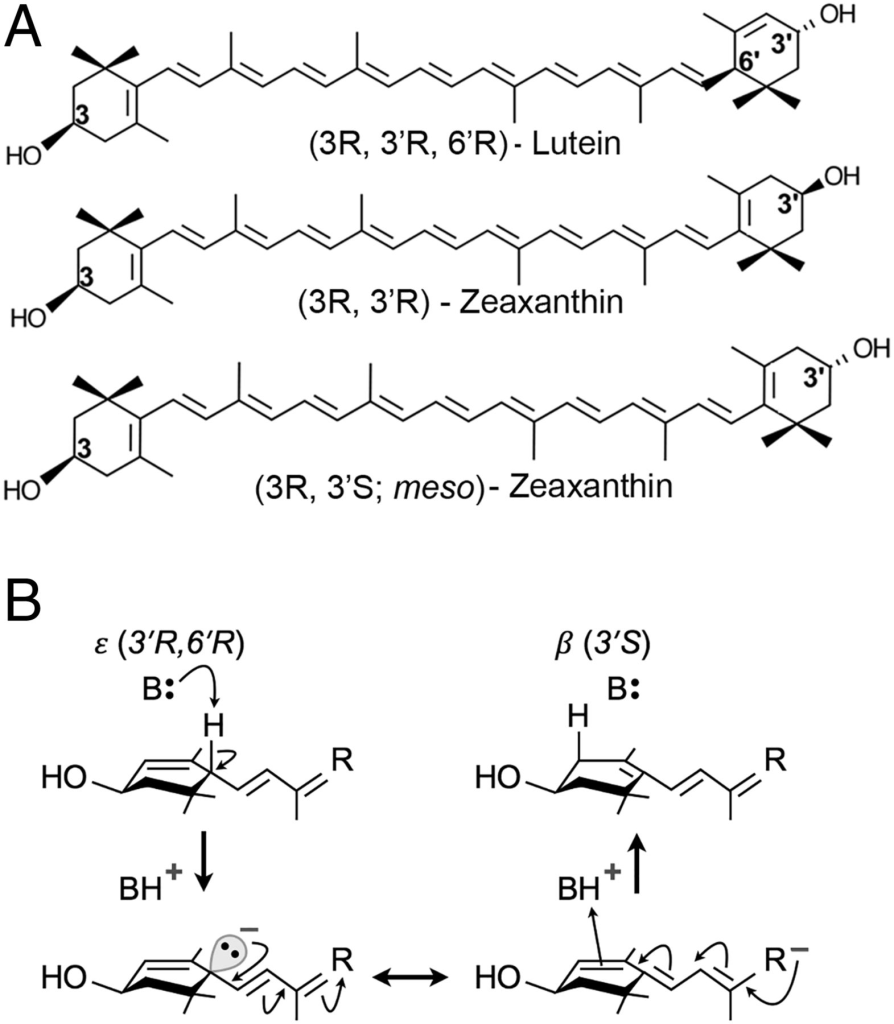
(A)展示了黄斑叶黄素(类胡萝卜素)的化学结构。
(B)描述了叶黄素转化为内消旋玉米黄素的简单协同酸碱催化机制。第一步涉及碱催化下从ε‑紫罗酮环的C6′位置抽取质子。预期中间体上的负电荷通过共振得到稳定(双头箭头所示)。在最后一步,BH⁺作为质子供体,附着于紫罗酮环的新C4′位置。此处所示的机制阐明了体内转化可能发生的方式;其他涉及自由基化学的替代机制(如氢原子转移)亦可能存在。
为了探究内消旋玉米黄素形成的生化机制,我们实验室在发育中的鸡胚胎中进行了研究。在这个独立的系统中,我们确定内消旋玉米黄素在鸡胚胎的视网膜色素上皮(RPE)/脉络膜中以发育调节的方式生成,来源于蛋黄中天然存在的叶黄素和玉米黄素(10)。在先前研究中,我们检测到E17胚胎的RPE/脉络膜中存在内消旋玉米黄素,且随着胚胎接近孵化(E21),其含量逐渐增加(10)。内消旋玉米黄素在视网膜中的检测仅在E19时出现,而其他检查的组织(脑、肝、血清和蛋黄)均无此类胡萝卜素。由于蛋在黑暗中孵化,我们排除了光在内消旋玉米黄素生成中的作用。在本研究中,我们提供了证据,表明RPE65,脊椎动物视觉循环中负责将全反式视黄基棕榈酸酯异构化为11‑顺式视黄醇的异构水解酶(11–14),同时也是叶黄素转化为内消旋玉米黄素的异构酶。
结果
RPE65在E21鸡RPE/脉络膜中的转录本和蛋白质水平显著上调
为了识别负责在鸡RPE/脉络膜中生成内消旋玉米黄素的酶,我们进行了RNA测序,以确定可能候选基因的转录本是否上调。我们使用了从E16 RPE/脉络膜(此阶段RPE/脉络膜中未检测到内消旋玉米黄素)分离的总RNA,并比较其mRNA转录本表达谱与E21 RPE/脉络膜(此阶段存在大量内消旋玉米黄素)的表达谱。比较了每个阶段至少三个胚胎的Log2 FPKM值,并绘制了通常涉及类胡萝卜素代谢和运输(GSTP1、STARD3、STARD1、BCO1、BCO2、SCARB1、SCARB2和CD36)或视黄醇代谢和运输(RBP1、IRBP、CRALBP、RPE65、LRAT、CYP27C1、STRA6和DES1)的基因转录本相对丰度(图2)。在我们考虑的基因中,RPE65在E16和E21之间上调最为显著,其转录本水平在E21比E16高23倍。GSTP1和STARD3分别为玉米黄素和叶黄素结合蛋白(15,16),其转录本水平在E16和E21之间无显著增加。BCO1和BCO2是类胡萝卜素氧化酶(17–20),其基因在E21略有上调。STRA6是一种视黄醇运输蛋白(21),DES1是视网膜穆勒细胞中表达的维生素A异构酶(22)。虽然STRA6 mRNA在E21上调,但其增幅低于RPE65。DES1 mRNA水平在发育期间无变化。SCARB1、SCARB2和CD36是眼中类胡萝卜素运输蛋白(23)。虽然SCARB1在E16和E21之间水平增加,但其催化内消旋玉米黄素生成的可能性不大。LRAT,视觉色素再生所需的酰基转移酶,在E21适度上调(12–14)。CYP27C1,一种已知将维生素A1转化为维生素A2的蛋白(24),在E16和E21之间转录本丰度下降。视黄醇运输蛋白如IRBP、CRALBP和RBP1的表达无显著差异。根据RNA测序数据,我们得出结论,在涉及视觉循环和类胡萝卜素代谢的相关基因中,RPE65最有可能负责内消旋玉米黄素的生成,特别是因为它是两种类胡萝卜素代谢酶BCO1和BCO2的亲属。

各基因的 FPKM 值与所有样本的平均表达量进行比较。每个样本的基因表达量与平均值的比值取对数(以 2 为底,log₂)后绘制。数值为正表示高于平均表达量;数值为负表示低于平均表达量。
接下来,我们确定了RPE65的蛋白质表达谱是否与mRNA水平呈现相似趋势。在E16鸡胚RPE/脉络膜中未检测到RPE65蛋白质,而在E21组织中观察到其强烈表达(图S1)。

RPE65过表达导致HEK293T细胞中的内消旋玉米黄素生成
为了确定RPE65是否能够催化叶黄素向内消旋玉米黄素的转化,我们选用了来源于人胚肾且不表达RPE65或LRAT的HEK293T细胞系(12,13)。转染pCDNA3.1-CRPE65(鸡RPE65)后48小时,HEK293T细胞中检测到RPE65的强烈表达,并持续4天;未转染细胞未检测到RPE65(图3A)。我们向细胞培养基中加入经高效液相色谱(HPLC)纯化的叶黄素,该叶黄素中不含可检测的内消旋玉米黄素,且玉米黄素含量低于0.5%(图4B),且HEK293T细胞本身不含内源性类胡萝卜素(图4C)。在含4 μM叶黄素的条件下培养4天后,仅在RPE65过表达组中检测到内消旋玉米黄素生成,并且其水平随时间逐渐升高;对照组(转染pCDNA3.1-GFP)细胞中未检测到内消旋玉米黄素(图3B、3C;图4D、4E)。通过比较生物合成产物与标准类胡萝卜素在HPLC中的保留时间(图4A),并结合在线光电二极管阵列检测到的典型三峰吸收光谱(峰值约450 nm,图4F及图S2),我们确认了所生成色素即为内消旋玉米黄素。在实验组与对照组细胞中均检测到少量玉米黄素,其含量亦随培养时间增加(图3B、3C),这可能归因于起始叶黄素中含约0.5%的玉米黄素。为排除叶黄素代谢前体为玉米黄素的可能性,我们又以4 μM高纯度异构玉米黄素(不含可检测的叶黄素)处理上述细胞;结果在实验组及对照组均未检测到内消旋玉米黄素或叶黄素(图3E、3F)。
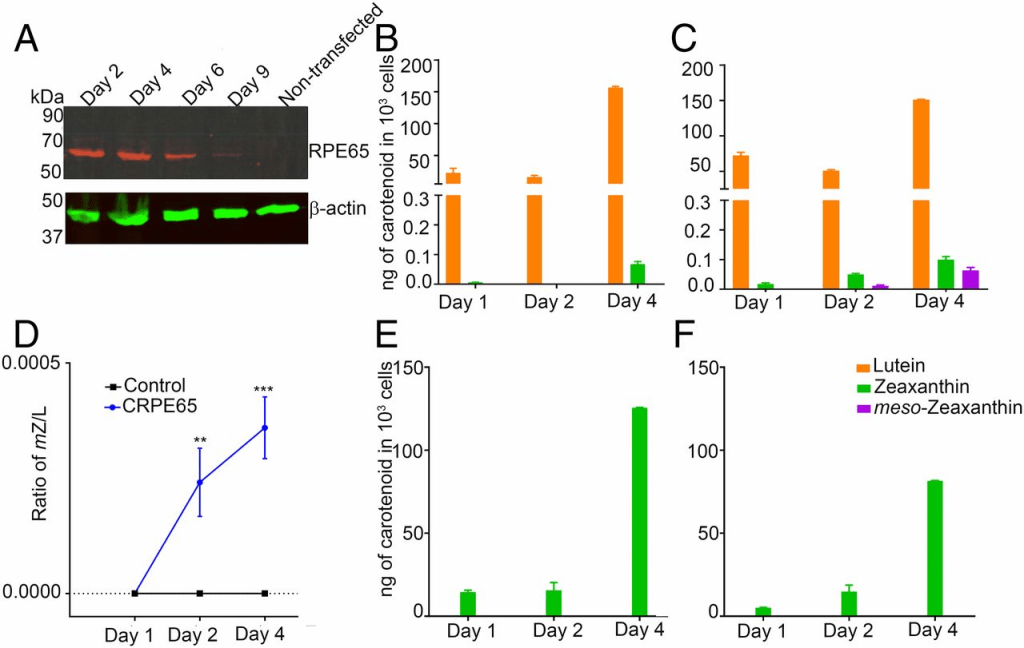
未转染的 HEK293T 细胞不表达 RPE65,但通过瞬时转染可使该基因表达数天(图 A)。以 4 μM 叶黄素处理 CRPE65 转染的细胞可导致内消旋玉米黄素生成(图 C),而转染对照质粒的细胞则未检测到内消旋玉米黄素(图 B)。内消旋玉米黄素与叶黄素的比值随时间增加(图 D)。在转染对照质粒的细胞(图 E)或 CRPE65 过表达的细胞中以 4 μM 玉米黄素处理均未产生内消旋玉米黄素(图 F)。n = 3。误差线表示标准误差(SEM)。P < 0.005;*P < 0.0005。
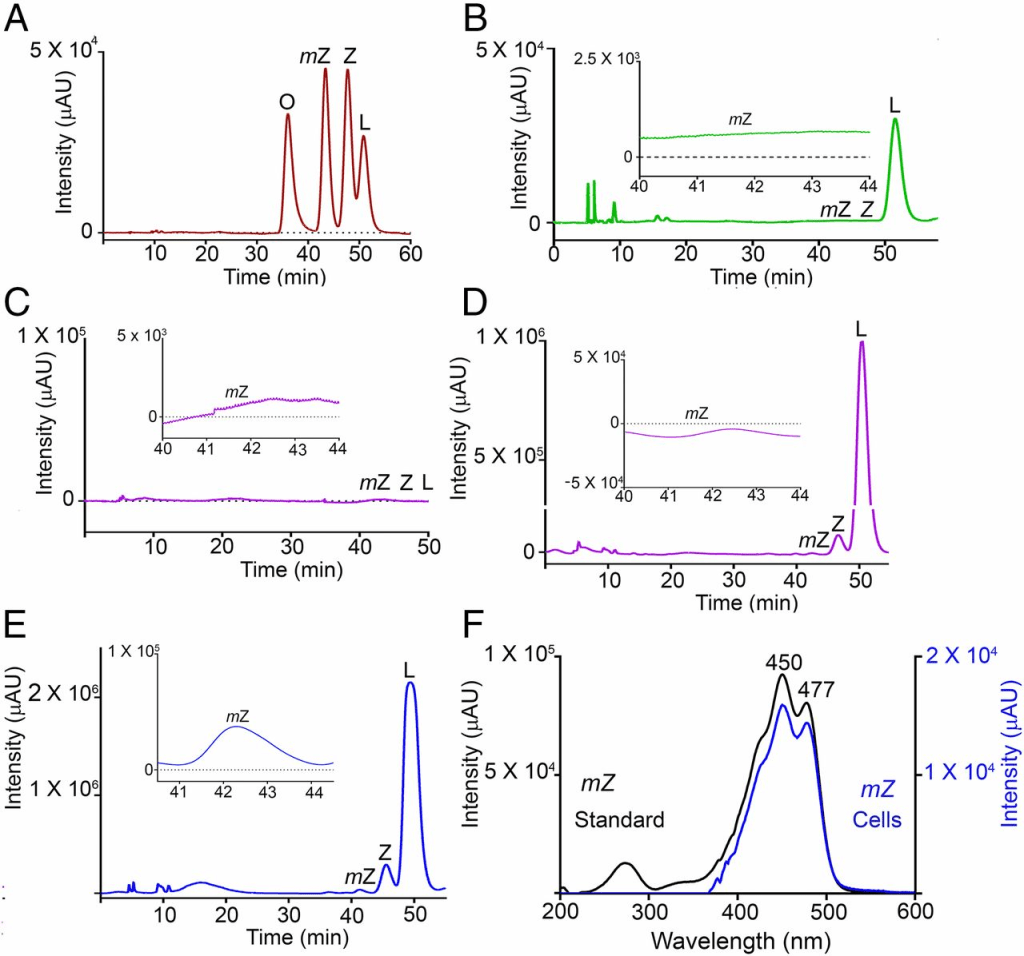

使用在线光电二极管阵列检测器测量类胡萝卜素标准品的吸收光谱。叶黄素的特征峰分别出现在444 nm和473 nm处(图A);玉米黄素(图B)和内消旋玉米黄素(图C)的特征峰则分别出现在450 nm和477 nm处。
先前研究显示,鸡源 RPE65(CRPE65)相较于其人类对应物(HRPE65)具有更优的异构水解酶活性(25)。我们开展了下一组实验,以比较人源 RPE65(HRPE65)与鸡源 RPE65(CRPE65)在内消旋玉米黄素异构化方面的差异(图 S3)。结果发现,HRPE65 转染细胞在第 2 天产生的内消旋玉米黄素略低于 CRPE65;但至第 4 天时,CRPE65 与 HRPE65 过表达细胞中的内消旋玉米黄素水平相当(图 3C 和 图 S3C)。同样地,在以 4 μM 玉米黄素处理 HRPE65 过表达细胞时,未检测到内消旋玉米黄素,对照组细胞中亦无此类胡萝卜素检出(图 S3E 和 S3F)。比较 CRPE65 与 HRPE65 过表达细胞中叶黄素与内消旋玉米黄素的比率表明,4 天内的转化率均低于 0.05%(图 3D 和 图 S3D)。
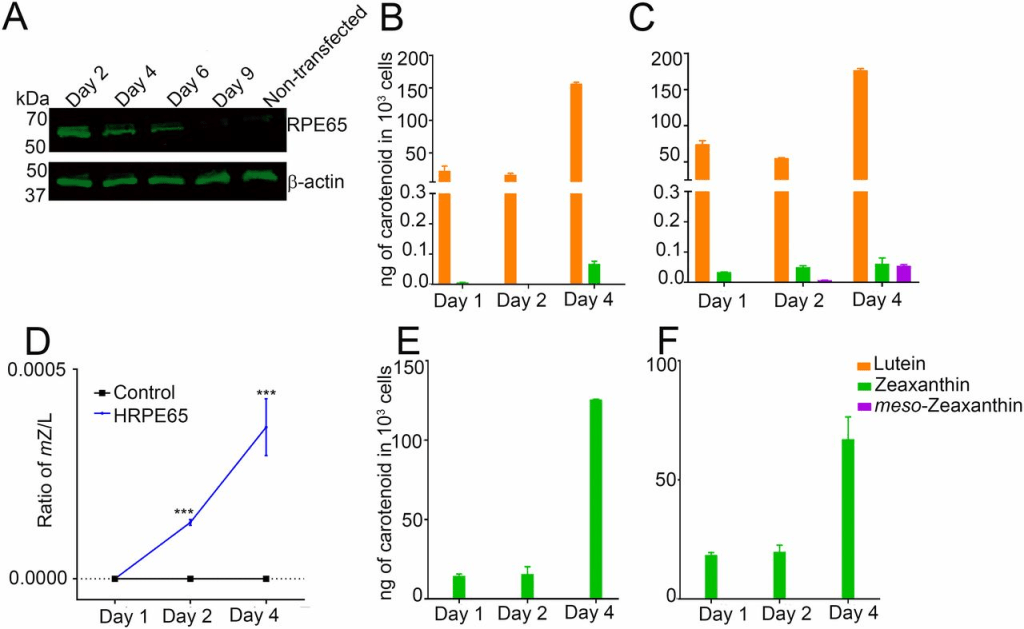
(B 和 C)转染对照质粒的细胞经叶黄素处理未产生内消旋玉米黄素(图B),而HRPE65过表达细胞则生成此类胡萝卜素(图C)。
(D)在HRPE65过表达细胞中,内消旋玉米黄素与叶黄素的比值随时间增加。
(E 和 F)以玉米黄素处理对照质粒过表达细胞(图E)或HRPE65过表达细胞(图F)均未产生内消旋玉米黄素。
n = 3。误差条表示标准误差(SEM)。***P < 0.0005。
E21鸡RPE原代细胞保留RPE65表达并能产生内消旋玉米黄素
在这些实验中,我们探讨了来自E21鸡胚胎的RPE原代培养细胞在叶黄素处理后是否能产生内消旋玉米黄素。不同于人类原代RPE细胞,这些细胞即使在五次传代后仍保留RPE65的表达(26)(图5A)。以2 μM叶黄素处理10^7个细胞2天后,检测到内消旋玉米黄素的存在(图5B)。在第2天至第4天之间,我们观察到内消旋玉米黄素水平逐渐增加。为了确定更高的前体浓度是否会导致内消旋玉米黄素生成增加,我们以4 μM叶黄素处理这些细胞。与以2 μM叶黄素处理的细胞相比,这些细胞在第2、3和4天产生显著更高量的内消旋玉米黄素(图5B)。

(A)来自E21鸡胚胎的RPE原代细胞仍保留RPE65的表达。
(B)以2 μM叶黄素处理2天后,这些细胞产生内消旋玉米黄素;以4 μM叶黄素处理时,观察到更高水平的内消旋玉米黄素生成。n = 3。误差线表示标准误差(SEM)。P < 0.005;*P < 0.0005。
在发育中鸡胚胎中药理抑制 RPE65 降低内消旋玉米黄素水平
接下来,我们检验了药理抑制 RPE65 活性是否能特异性地抑制内消旋玉米黄素的生成。我们先前的研究显示,内消旋玉米黄素在鸡 RPE/脉络膜中于胚胎发育第 17 天(E17)首次出现可检测水平。因此,我们决定在 E17 时将 RPE65 活性的竞争性抑制剂引入鸡胚胎的卵黄囊中。
我们使用药理抑制剂 ACU‑5200‑HCl(简称 ACU‑5200)来敲低 RPE65 功能。ACU‑5200 是 emixustat 的类似物,emixustat 是一种高选择性的 RPE65 抑制剂,正处于用于治疗 Stargardt 病的临床试验阶段(27–29)(图 6A)。ACU‑5200 已显示在小鼠中以极低口服剂量(ED₅₀ = 0.27 mg/kg;Acucela Inc. 提供的专有数据)即可抑制 11‑顺式视黄醇的生成。我们分别在 E17 和 E19 向发育中胚胎的卵黄囊注射不同剂量的 ACU‑5200。经 ACU‑5200 注射的胚胎发育正常,无明显表型异常(图 6B)。注射两次每次 2 mg 的 ACU‑5200(共 2 × 2 mg)导致 RPE/脉络膜中内消旋玉米黄素水平显著下调(图 6C)。将剂量加倍后,注射胚胎的 RPE/脉络膜中完全未检测到内消旋玉米黄素(图 6D)。经 ACU‑5200 注射的胚胎 RPE/脉络膜中的叶黄素和玉米黄素含量与对照胚胎相当(图 6C 和 6D)。这些结果表明,在体内系统中,RPE65 的功能对内消旋玉米黄素的生成是必需的。
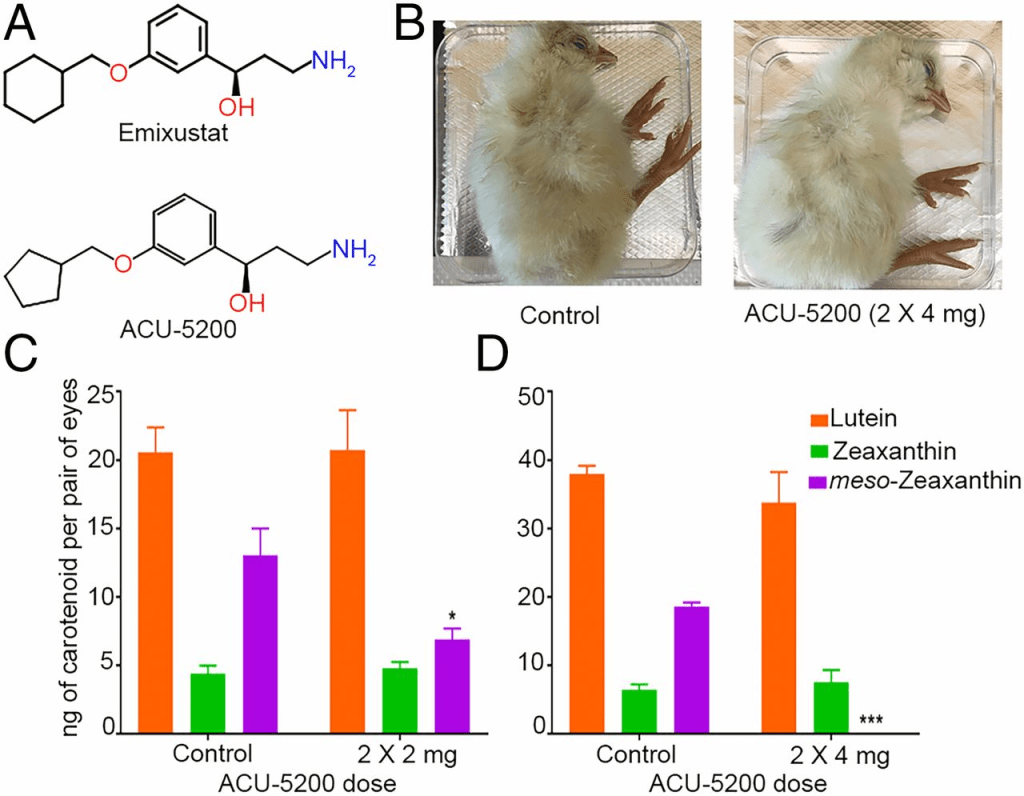
(A)ACU‑5200 是 emixustat 的类似物。
(B)经 ACU‑5200 注射的胚胎发育与对照胚胎相当。
(C 和 D)与对应的对照胚胎相比,经 ACU‑5200 注射的胚胎在叶黄素或玉米黄素水平上无显著差异;内消旋玉米黄素水平在注射后显著下调或完全缺失。n ≥ 5。误差线表示标准误差(SEM)。P < 0.05;**P < 0.0005。
结构对接实验显示叶黄素的ε环可适配于RPE65的活性位点
为了确定叶黄素是否适配于RPE65的底物通道,我们将叶黄素分子对接至鸡RPE65的同源模型。图7展示了一个代表性结果,该结果最小化了立体冲突并最大化了氢键。叶黄素的ε‑紫罗酮环位于由铁配位组氨酸残基构成的平台上,而β‑紫罗酮环则从酶表面的开口处突出。埋藏的羟基与两个氢键结合基团(Trp‑331的吲哚胺和Glu‑417的羧酸根;图S4)相互靠近定位。立体互补性显而易见,苯丙氨酸残基在ε‑紫罗酮环的两侧毗邻,并与聚烯链形成堆叠。参与异构化的C4′、C5′和C6′原子所在的紫罗酮环边缘始终被发现更靠近铁中心和组氨酸残基。在适配良好的对接构象中,未观察到这些原子指向远离铁中心的结果,这可能是因为在此取向下,叶黄素分子的曲率与RPE65底物通道的曲率不匹配。
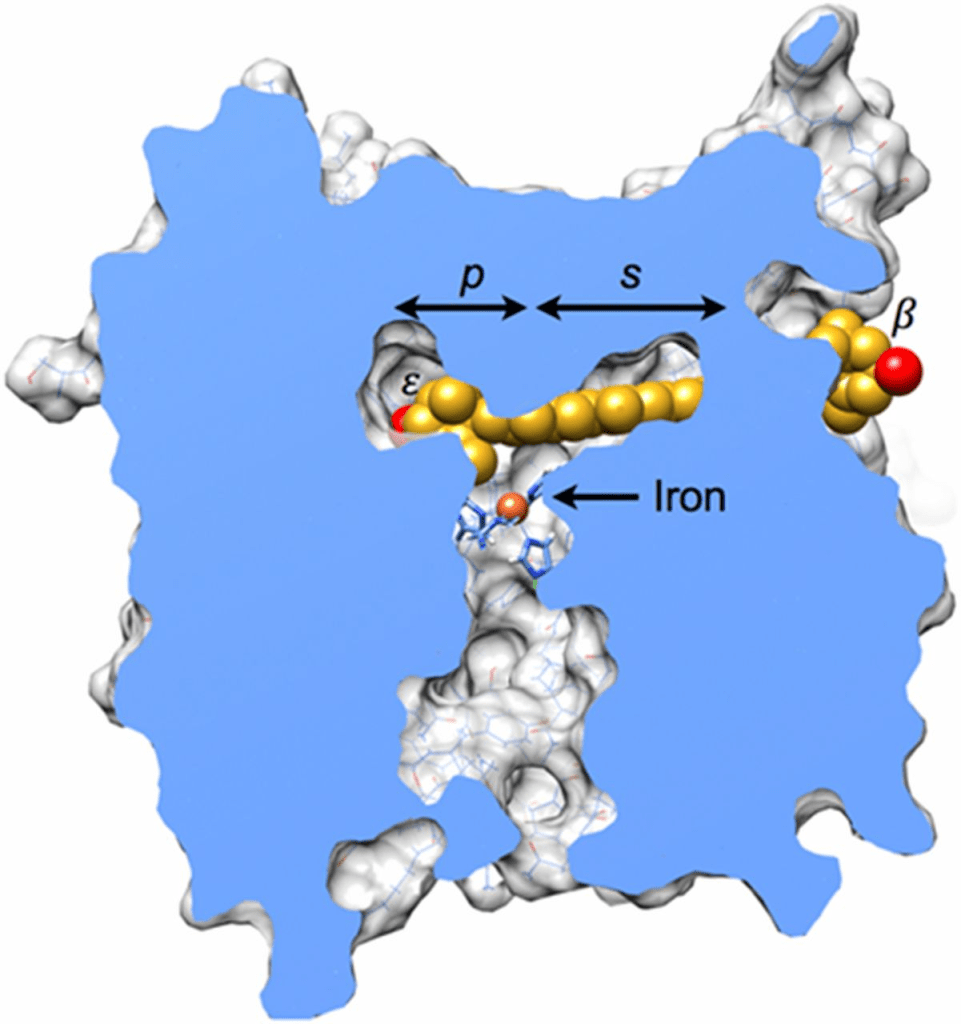
图中展示了一个叶黄素分子(碳原子为金色,氧原子为红色)对接到鸡 RPE65 同源模型中的情况。在此视图中,大部分蛋白质结构已被移除,以便显示位于内部的底物通道。棕榈酸结合口袋(p)位于铁中心的上方和左侧,与叶黄素的 ε‑紫罗酮环重叠。聚烯链延伸穿过假定的底物结合口袋(s),该口袋由酶与其竞争性抑制剂 emixustat 复合物的结构所定义(29)。β‑紫罗酮环则从酶表面的一个开口处露出。分子相互作用的更详细视图见图 S4。本次粗略网格刚体对接实验未使用能量最小化。此处展示的代表性结果是从超过 33,000 次试验中选出,因其立体冲突较少(n = 9;冲突定义为原子间距小于 3 Å)且形成了两个氢键。通过对叶黄素分子的扭转角度细微调整及对侧链的重新定位,可进一步消除立体冲突。作为比较,将叶黄素按相同刚体对接协议对接至 StARD3 的隧道状腔体会产生 14 处冲突(42),而棕榈酸和 emixustat 与 RPE65 结合时仅有两处冲突;在叶绿素结合蛋白结构中的叶黄素分子通常无冲突(42)。此图使用 UCSF Chimera 绘制(43,44)。
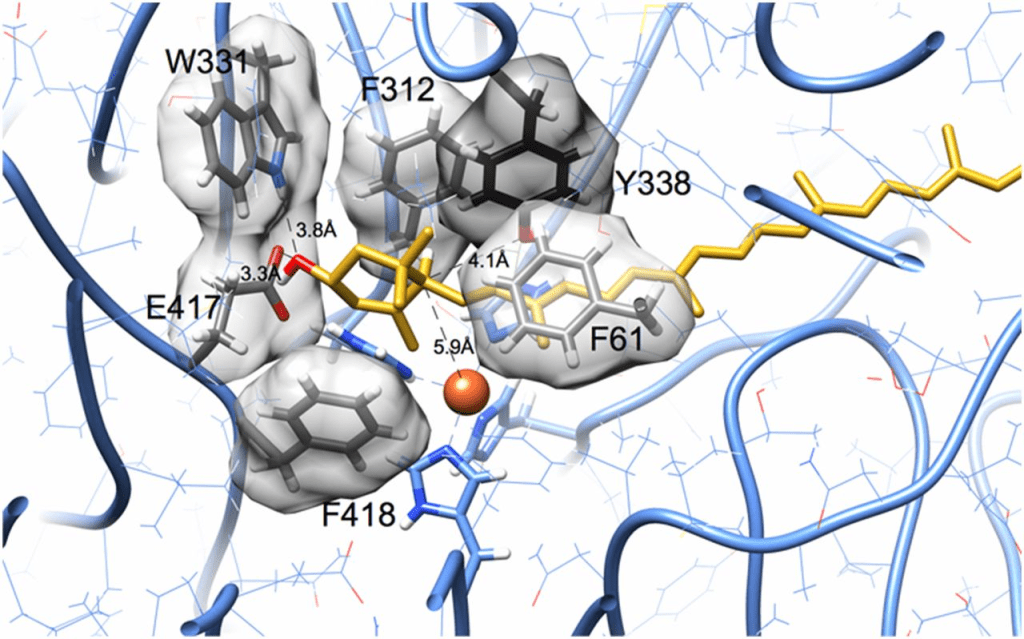
叶黄素的 ε‑紫罗酮环适配于一个由芳香族侧链衬里的口袋中。羟基靠近 Trp‑331 和 Glu‑417 残基中的潜在氢键供体与受体。这些残基参与一个氢键网络,通过对侧链构象的适度调整,可重新排列以包括叶黄素的羟基。在异构化过程中,附着于 C6′ 的氢原子迁移至 C4′。铁中心(橙色球体)与环碳 C5′ 最近,并且与 C6′ 和 C4′ 的距离大致相等。C6′ 原子距 Tyr‑338 的羟基 4.1 Å,距铁中心(橙色球体) 5.9 Å。此图使用 UCSF Chimera 绘制(43,44)。
材料与方法
总RNA分离与RNA测序
使用 Qiagen RNeasy 试剂盒从 E16 和 E21 鸡胚胎中分离总 RNA。取 100–500 ng 总 RNA,通过寡聚(dT)磁珠纯化完整的 poly(A) RNA,并使用 Illumina TruSeq Stranded mRNA Library Preparation Kit 构建链式 mRNA 测序文库。详细流程见 SI 材料与方法。
细胞培养与瞬态转染
建立 E21 鸡胚胎 RPE 原代细胞培养;HEK293T 细胞(人胚肾来源,不内源性表达 RPE65 或 LRAT)在含 10% FBS 和 1% 抗生素-抗真菌混合物的 DMEM 中培养。使用 jetPRIME 试剂按厂商说明进行瞬态转染,过表达质粒包括 pCDNA3.1-鸡 RPE65、pCDNA3.1-人 RPE65(均由 Jian‑Xing Ma 慷慨提供)或 pCDNA3.1-GFP(OriGene)。
类胡萝卜素处理
HPLC 纯化的叶黄素由 Kemin Health 提供,玉米黄素由 Zeavision 提供,内消旋玉米黄素由 DSM 提供。将类胡萝卜素储备溶于己烷中配制,加入 0.3% Tween 40 后在氮气下干燥。向干燥混合物中加入完全培养基,冰上超声 30 分钟,室温涡旋 20 分钟,以含 0、1、2 或 4 天的培养基处理细胞。处理后,用冰冷 10 mM 牛磺酸钠洗涤以去除表面吸附,再用 PBS 洗净,刮下细胞并以 16 200 × g 离心 5 分钟,去除上清备用。
类胡萝卜素提取与HPLC分析
向细胞团中加入含 0.1% 丁基羟基甲苯的四氢呋喃(THF),冰上超声 10 分钟,涡旋 5 分钟,16 200 × g 离心 10 分钟,收集上清于氮气下干燥。重复三次确保提取完全。按照先前描述的方法及 SI 材料与方法进行手性 HPLC 分析。
蛋白质分离与西方墨点分析
在 4 °C 下使用含蛋白酶抑制剂的 RIPA 缓冲液(25 mM NaCl,0.5 mM EDTA,25 mM Tris⋅HCl pH 7.2,0.1% Tween 20)匀浆细胞/组织,离心去除碎片。BCA 法定量后,以 9% SDS–PAGE 分离 20 μg 蛋白,半干转移至 0.45 μm 硝酸纤维素膜(25 V,1 h)。膜在含 0.01% Tween 20 的 TBS 洗涤,1 h 封闭于 Odyssey Blocking Buffer(含 0.01% Tween 20)。主要抗体:DALEED 鸡 RPE65(1∶1 000)、PETLET 人 RPE65(1∶1 000)(均由 Jian‑Xing Ma 提供),小鼠单克隆 β‑肌动蛋白(8H10D10,Cell Signaling,1∶5 000);二抗为 IR 染料偶联抗体(LI‑COR,1∶10 000),室温孵育 1 h,Odyssey 成像系统成像。
鸡胚胎的抑制剂处理
用 70% 乙醇擦拭蛋壳侧面,并用电工胶带固定定位。用 18 号针头在胶带上穿孔,使用 21 号针头将 0.1 mL 含 1% 青霉素‑链霉素的 Ringer 溶液或含 ACU‑5200 的 Ringer 溶液注入胚胎卵黄囊,注射后用胶带封口,保持注射面朝上继续孵育。
叶黄素的刚体对接
使用 Phyre2 构建鸡 RPE65 同源模型(基于牛 RPE65 结构,PDB ID: 4RSC、3FSN;鸡牛序列同一性 89%)。从植物叶绿素结合蛋白复合物(PDB ID: 1RWT、3JCU、3PL9、4XK8)提取叶黄素坐标;以 RPE65–emixustat 复合物(PDB ID: 4RSC)中棕榈酸与 emixustat 位置为初始引导,通过手动增补定位并生成 33 738 次对接试验。评分依据无能量最小化的刚体对接:非氢原子间距 < 3 Å 计为冲突,电负性原子间距 2.0–4.2 Å 计为潜在氢键。对接程序由 M.P.H. 编写的 C 程序实现(42)。
本文翻译自论文Shyam R, Gorusupudi A, Nelson K, Bernstein PS. RPE65 has an additional function as the lutein to meso-zeaxanthin isomerase in the vertebrate eye. Proc Natl Acad Sci U S A. 2017;114(41):10882-10887. doi:10.1073/pnas.1706332114
參考文獻
- CC Huang, EC Meng, JH Morris, EF Pettersen, TE Ferrin, Enhancing UCSF Chimera through web services. Nucleic Acids Res 42, W478–W484 (2014).
- T Maoka, A Arai, M Shimizu, T Matsuno, The first isolation of enantiomeric and meso-zeaxanthin in nature. Comp Biochem Physiol B 83, 121–124 (1986).
- PS Bernstein, et al., Lutein, zeaxanthin, and meso-zeaxanthin: The basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease. Prog Retin Eye Res 50, 34–66 (2016).
- B Li, P Vachali, PS Bernstein, Human ocular carotenoid-binding proteins. Photochem Photobiol Sci 9, 1418–1425 (2010).
- M Katsuyama, T Komori, T Matsuno, Metabolism of three stereoisomers of astaxanthin in the fish, rainbow trout and tilapia. Comp Biochem Physiol B 86, 1–5 (1987).
- JM Nolan, et al., Verification of meso-zeaxanthin in fish. J Food Process Technol 5, 335 (2014).
- EY Chew, et al., Secondary analyses of the effects of lutein/zeaxanthin on age-related macular degeneration progression: AREDS2 report no. 3. JAMA Ophthalmol; Age-Related Eye Disease Study 2 (AREDS2) Research Group 132, 142–149 (2014).
- P Bhosale, B Serban, DY Zhao, PS Bernstein, Identification and metabolic transformations of carotenoids in ocular tissues of the Japanese quail Coturnix japonica. Biochemistry 46, 9050–9057 (2007).
- EJ Johnson, M Neuringer, RM Russell, W Schalch, DM Snodderly, Nutritional manipulation of primate retinas, III: Effects of lutein or zeaxanthin supplementation on adipose tissue and retina of xanthophyll-free monkeys. Invest Ophthalmol Vis Sci 46, 692–702 (2005).
- RA Bone, JT Landrum, GW Hime, A Cains, J Zamor, Stereochemistry of the human macular carotenoids. Invest Ophthalmol Vis Sci 34, 2033–2040 (1993).
- A Gorusupudi, et al., Developmentally regulated production of meso-zeaxanthin in chicken retinal pigment epithelium/choroid and retina. Invest Ophthalmol Vis Sci 57, 1853–1861 (2016).
- PS Bernstein, WC Law, RR Rando, Isomerization of all-trans-retinoids to 11-cis-retinoids in vitro. Proc Natl Acad Sci USA 84, 1849–1853 (1987).
- G Moiseyev, Y Chen, Y Takahashi, BX Wu, J-X Ma, RPE65 is the isomerohydrolase in the retinoid visual cycle. Proc Natl Acad Sci USA 102, 12413–12418 (2005).
- M Jin, S Li, WN Moghrabi, H Sun, GH Travis, Rpe65 is the retinoid isomerase in bovine retinal pigment epithelium. Cell 122, 449–459 (2005).
- TM Redmond, et al., Mutation of key residues of RPE65 abolishes its enzymatic role as isomerohydrolase in the visual cycle. Proc Natl Acad Sci USA 102, 13658–13663 (2005).
- P Bhosale, et al., Identification and characterization of a Pi isoform of glutathione S-transferase (GSTP1) as a zeaxanthin-binding protein in the macula of the human eye. J Biol Chem 279, 49447–49454 (2004).
- B Li, P Vachali, JM Frederick, PS Bernstein, Identification of StARD3 as a lutein-binding protein in the macula of the primate retina. Biochemistry 50, 2541–2549 (2011).
- K-Q Hu, et al., The biochemical characterization of ferret carotene-9′,10′-monooxygenase catalyzing cleavage of carotenoids in vitro and in vivo. J Biol Chem 281, 19327–19338 (2006).
- C Kiefer, et al., Identification and characterization of a mammalian enzyme catalyzing the asymmetric oxidative cleavage of provitamin A. J Biol Chem 276, 14110–14116 (2001).
- A Wyss, et al., Expression pattern and localization of β,β-carotene 15,15′-dioxygenase in different tissues. Biochem J 354, 521–529 (2001).
- TM Redmond, et al., Identification, expression, and substrate specificity of a mammalian β-carotene 15,15′-dioxygenase. J Biol Chem 276, 6560–6565 (2001).
- R Kawaguchi, et al., A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science 315, 820–825 (2007).
- JJ Kaylor, et al., Identification of DES1 as a vitamin A isomerase in Müller glial cells of the retina. Nat Chem Biol 9, 30–36 (2013).
- P Borel, et al., CD36 and SR-BI are involved in cellular uptake of provitamin A carotenoids by Caco-2 and HEK cells, and some of their genetic variants are associated with plasma concentrations of these micronutrients in humans. J Nutr 143, 448–456 (2013).
- JM Enright, et al., Cyp27c1 red-shifts the spectral sensitivity of photoreceptors by converting vitamin A1 into A2. Curr Biol 25, 3048–3057 (2015).
- G Moiseyev, Y Takahashi, Y Chen, S Kim, J-X Ma, RPE65 from cone-dominant chicken is a more efficient isomerohydrolase compared with that from rod-dominant species. J Biol Chem 283, 8110–8117 (2008).
- CP Hamel, et al., Molecular cloning and expression of RPE65, a novel retinal pigment epithelium-specific microsomal protein that is post-transcriptionally regulated in vitro. J Biol Chem 268, 15751–15757 (1993).
- PU Dugel, et al., Phase II randomized, placebo-controlled, 90-day study of emixustat hydrochloride in geographic atrophy associated with dry age-related macular degeneration. Retina 35, 1173–1183 (2015).
- LS Jack, MA Sadiq, DV Do, QD Nguyen, Emixustat and lampalizumab: Potential therapeutic options for geographic atrophy. Dev Ophthalmol 55, 302–309 (2016).
- PD Kiser, et al., Catalytic mechanism of a retinoid isomerase essential for vertebrate vision. Nat Chem Biol 11, 409–415 (2015).
- B Li, F Ahmed, PS Bernstein, Studies on the singlet oxygen scavenging mechanism of human macular pigment. Arch Biochem Biophys 504, 56–60 (2010).
- R Crosby-Nwaobi, P Hykin, T Peto, S Sivaprasad, An exploratory study evaluating the effects of macular carotenoid supplementation in various retinal diseases. Clin Ophthalmol 10, 835–844 (2016).
- JM Nolan, et al., Enrichment of macular pigment enhances contrast sensitivity in subjects free of retinal disease: Central retinal enrichment supplementation trials. Report 1. Invest Ophthalmol Vis Sci 57, 3429–3439 (2016).
- GJ McKay, et al., Investigation of genetic variation in scavenger receptor class B, member 1 (SCARB1) and association with serum carotenoids. Ophthalmology 120, 1632–1640 (2013).
- D Babino, et al., The biochemical basis of vitamin A3 production in arthropod vision. ACS Chem Biol 11, 1049–1057 (2016).
- DP Kloer, GE Schulz, Structural and biological aspects of carotenoid cleavage. Cell Mol Life Sci 63, 2291–2303 (2006).
- DP Kloer, S Ruch, S Al-Babili, P Beyer, GE Schulz, The structure of a retinal-forming carotenoid oxygenase. Science 308, 267–269 (2005).
- X Sui, PD Kiser, Jv Lintig, K Palczewski, Structural basis of carotenoid cleavage: From bacteria to mammals. Arch Biochem Biophys 539, 203–213 (2013).
- PP Vachali, BM Besch, F Gonzalez-Fernandez, PS Bernstein, Carotenoids as possible interphotoreceptor retinoid-binding protein (IRBP) ligands: A surface plasmon resonance (SPR)-based study. Arch Biochem Biophys 539, 181–186 (2013).
- O Voolstra, et al., The Drosophila class B scavenger receptor NinaD-I is a cell surface receptor mediating carotenoid transport for visual chromophore synthesis. Biochemistry 45, 13429–13437 (2006).
- LA Kelley, S Mezulis, CM Yates, MN Wass, MJE Sternberg, The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc 10, 845–858 (2015).
- PD Kiser, M Golczak, DT Lodowski, MR Chance, K Palczewski, Crystal structure of native RPE65, the retinoid isomerase of the visual cycle. Proc Natl Acad Sci USA 106, 17325–17330 (2009).
- MP Horvath, et al., Structure of the lutein-binding domain of human StARD3 at 1.74 Å resolution and model of a complex with lutein. Acta Crystallogr F Struct Biol Commun 72, 609–618 (2016).
- EF Pettersen, et al., UCSF Chimera: A visualization system for exploratory research and analysis. J Comput Chem 25, 1605–1612 (2004).